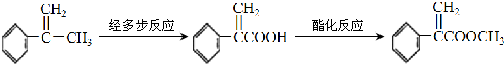题目内容
19. 前36号元素A、B、C、D的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半充满结构,C最外层电子数是电子层数的三倍.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均全充满.请回答下列问题:
前36号元素A、B、C、D的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半充满结构,C最外层电子数是电子层数的三倍.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均全充满.请回答下列问题:(1)A、B、C第一电离能由小到大的顺序为C<O<N;基态D原子的价电子排布式为3d104s1.
(2)BC3-的空间构型为平面三角形.
(3)1molAB-中含有的π键数目为2NA个.
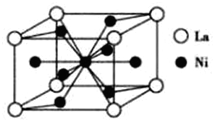
(4)已知镧镍合金LaNin晶胞(结构如图)体积为9.0×10-23cm3,储氢后形成LaNinH3.5合金(晶胞体积不变,则n=5;氢在合金中的密度为0.065g/cm2(保留小数点后三位数字).
分析 A、B、C、D都是前36号元素,它们的核电荷数依次增大,C最外层电子数是电子层数的三倍,原子只能有2个电子层,最外层电子数为6,故C是O元素;B原子的最外层p轨道的电子为半满结构,最外层电子排布为2s22p3,故B为N元素;第二周期元素A原子的核外成对电子数是未成对电子数的2倍,故原子核外电子排布为1s22s1或1s22s22p2,结合(3)能与N元素形成阴离子(AN-),故A为C元素;D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满,故D元素原子各层电子数分别为2、8、18、1,是29号Cu元素,据此解答.
解答 解:A、B、C、D都是前36号元素,它们的核电荷数依次增大,C最外层电子数是电子层数的三倍,原子只能有2个电子层,最外层电子数为6,故C是O元素;B原子的最外层p轨道的电子为半满结构,最外层电子排布为2s22p3,故B为N元素;第二周期元素A原子的核外成对电子数是未成对电子数的2倍,故原子核外电子排布为1s22s1或1s22s22p2,结合(3)能与N元素形成阴离子(AN-),故A为C元素;D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满,故D元素原子各层电子数分别为2、8、18、1,是29号Cu元素.
(1)C、N、O元素是同一周期元素,同一周期元素自左而右第一电离能呈增大趋势,但N元素原子2p能级是半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能C<O<N;
D的原子序数是29,为Cu元素,其原子核外电子排布式为:1s22s22p63s23p63d104s1,价电子排布式为:3d104s1,
故答案为:C<O<N;3d104s1;
(2)NO3-中N原子形成3个δ键,孤电子对=$\frac{5+1-2×3}{2}$=0,则应为平面三角形,
故答案为:平面三角形;
(3)将CN-中C原子及1个负电荷换成1个N原子,可得的等电子体N2,等电子体结构相似,CN-中形成C≡N三键,1个CN-含有2个π键,故1mol CN-中含有的π键个数为2NA,
故答案为:2NA;
(4)由晶胞结构可知,La原子处于顶点,晶胞中含有La原子数目为8×$\frac{1}{8}$=1,Ni原子处于晶胞内部与面上、面心,晶胞中Cu数目为1+4×$\frac{1}{2}$+4×$\frac{1}{2}$=5,故该合金中La和Ni的原子个数比为1:5,故n=5,
晶胞中拥有3.5个H原子,氢在合金中的密度为$\frac{\frac{3.5}{6.02×1{0}^{23}}g}{9.0×1{0}^{-23}c{m}^{3}}$=0.065g/cm3,
故答案为:5;0.065g/cm3.
点评 本题是对物质结构的考查,涉及电离能、分子构型、核外电子排布规律、等电子体原理应用、晶胞计算等知识点,是对物质结构知识的综合考查,侧重对知识迁移的运用、分析解决问题的能力考查,注意同一周期元素的第一电离能随着原子序数的增大而呈增大的趋势,但第IIA和第IIIA族、第VA族和第VIA族之间异常.

 精英口算卡系列答案
精英口算卡系列答案| A. | 苯、乙醇和乙酸都能发生取代反应 | |
| B. | 葡萄糖注射液不能产生丁达尔效应现象,不属于胶体 | |
| C. | 淀粉、油脂、蛋白质都能水解,但水解产物不同 | |
| D. | 白酒中混有少量塑化剂,少量饮用对人体无害,可通过过滤方法除去 |
| A. | 铝具有很强的抗腐蚀能力,是因为其不易与氧气发生反应 | |
| B. | 棉布,羊毛和绦纶燃烧后都生成二氧化碳和水 | |
| C. | 航天飞机上的陶瓷防护片属于新型无机非金属材料 | |
| D. | 食品保鮮膜、塑料水杯等生活用品的主要成分是聚氯乙烯 |
| A. | 碱在水中的溶解度 | B. | 乙酸溶液的pH | ||
| C. | 合成氨的反应热 | D. | 醋酸钠溶液中的氢氧根离子浓度 |
| A. | I A族和ⅦA族元素间可形成共价化合物或离子化合物 | |
| B. | 因H2SO3的酸性比H2CO3强,所以S的非金属性比C强 | |
| C. | H2O2、CH3CH3、Cl-、K+中的电子数和质子数均分别相等 | |
| D. | Na+、Al3+、O2-、F-的半径逐渐减小 |
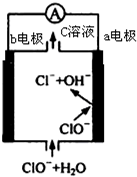 镁-次氯酸盐燃料电池的工作原理如图,该电池反应为:Mg+ClO -+H2O═Mg(OH)2+Cl-下列有关说法正确的是( )
镁-次氯酸盐燃料电池的工作原理如图,该电池反应为:Mg+ClO -+H2O═Mg(OH)2+Cl-下列有关说法正确的是( )| A. | 电池工作时,C溶液中的溶质是MgCl2 | |
| B. | 电池工作时,正极a附近的PH将不断增大 | |
| C. | 负极反应式:ClO --2e -+H2O═Cl-+2 OH- | |
| D. | b电极发生还原反应,每转移0.1mol电子,理论上生成0.1mol Cl- |
| A. | 食盐 | B. | 蔗糖 | C. | 白醋 | D. | 面粉 |
| A. | 含大量Fe3+的溶液中:Na+、Mg2+、SO42-、SCN- | |
| B. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=106的溶液中:NH4+、K+、AlO2-、NO3- | |
| C. | 能使甲基橙变红的溶液中:Cu2+、Mg2+、SO42-、Cl- | |
| D. | 1.0 mol•L-1的KNO3溶液中:Fe2+、H+、Cl-、I- |

 ;反应③
;反应③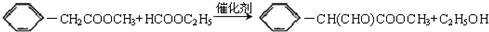 .
.