题目内容
1.关于化学反应速率及化学平衡,下列说法正确的是( )①恒温时,增大压强,化学反应速率一定加快
②其他条件不变,温度越高,活化分子百分数增加,活化分子浓度也增加,反应速率加快
③使用催化剂可改变反应速率,从而改变该反应过程中吸收或放出的热量
④3mol•L-1•s-1的反应速率一定比1mol•L-1•s-1的反应速率大
⑤正反应速率越大,反应朝正反应方向进行的程度越大
⑥增加反应物的浓度,活化分子浓度增加,反应速率加快
⑦平衡向正反应方向移动,反应物的转化率都增大
⑧若在一定条件下,平衡向正反应方向移动,则正反应速率变大
⑨化学平衡常数越小,说明正反应进行程度越小,即该反应进行的就越不完全,转化率就越小
⑩温度越高,化学平衡常数就越大.
| A. | ①②④⑥⑧⑩ | B. | ②③⑦⑧⑨ | C. | ②⑤⑨ | D. | ②⑥⑨ |
分析 ①增大压强,不改变反应物或生成物的浓度,不改变化学反应速率;
②温度增加活化分子百分数;
③催化剂只改变化学反应速率,不影响平衡;
④化学反应有的快,有的慢,对于用同种物质表示的同种反应的化学反应速率,此规律适用;
⑤反应进行的方向取决于正逆反应速率的相对大小;
⑥增加反应物浓度,活化分子数增加;
⑦增加一种物质的浓度,可以加快另外一种物质的转化率,自身转化率降低;
⑧平衡移动的方向决定于正逆反应速率的相对大小,正反应速率增大,平衡不移动正向移动;
⑨在一定温度下,当可逆反应达到平衡状态时,与反应物浓度幂之积的比值为一个常数,简称平衡常数,平衡常数越大,生成物浓度越大,反应物浓度越小,反应物的转化率越大;
⑩对于放热反应,升高温度,K值减小.
解答 解:①氮气与氢气反应中,恒容下充入氩气,压强增大,不改变反应物或生成物的浓度,不改变化学反应速率,故错误;
②温度增加活化分子百分数,故其他条件不变,温度越高,活化分子百分数增加,活化分子浓度也增加,反应速率加快,故正确;
③催化剂只改变化学反应速率,不影响平衡,故错误;
④用同种物质表示的同一个化学反应适用,但是化学反应改变,意义改变,3mol•L-1•s-1的反应速率不一定比1mol•L-1•s-1的反应速率大,故错误;
⑤反应进行的方向取决于正逆反应速率的相对大小,故正反应速率增大,平衡不一定向正反应方向移动,故错误;
⑥增加反应物浓度,活化分子数增加,故正确;
⑦⑧给放热反应降温,正逆反应速率都减小,平衡正向移动,故错误;
⑨在一定温度下,当可逆反应达到平衡状态时,化学平衡常数K=$\frac{生成物浓度幂之积}{反应物浓度幂之积}$,K越大,说明平衡体系中生成物所占的比例越大,即生成物浓度越大,反应物浓度越小,它的正向反应进行的程度越大,即该反应进行得越完全,故正确;
⑩温度越高,化学平衡向吸热反应方向移动,如果正反应是吸热反应,则K增大,如果正反应是放热反应,则K减小,所以温度越高,K不一定越大,故错误;
故选D.
点评 本题考查化学反应速率的影响因素,侧重于基本概念的理解和应用,为高考常见题型和高频考点,难度不大,注意相关基础知识的积累.

 同步练习强化拓展系列答案
同步练习强化拓展系列答案| A. | 无色溶液中:[Ag(NH3)2]+、NH3•H2O、OH-、NO3-可以大量共存 | |
| B. | 常温常压下,22.4L乙烯中含C-H键的数目为4NA(NA表示阿伏加德罗常数的值) | |
| C. | 加入KSCN溶液显红色的溶液中,Na+、Ca2+、HCO3-、Br- 可以大量共存 | |
| D. | 标准状况下,2.24 L NH3溶于1L水中制得氨水,则c(NH3•H2O)=0.1mol•L-1 |
| A. | 只有一种结构 | B. | 有两种同分异构体 | ||
| C. | 属于四面体的空间结构 | D. | 是甲烷的一种同系物 |
| A. | 4种溶液的PH的大小是③>②>④>① | |
| B. | 若将4种溶液稀释相同的倍数,PH变化最大的是② | |
| C. | 若分别加入25 mL0.1 mol•L-1盐酸后,PH最大的是① | |
| D. | 若4种溶液的PH均为9,则物质的量浓度大小顺序是③>①>②>④ |
| A. | 有2个A原子 | B. | 有2个氧原子 | C. | 有1个A原子 | D. | 有1个氧原子 |
| A. | 澄清透明的无色溶液中:Cl-、MnO4-、Ag+、SO42- | |
| B. | 在能使pH试纸变深蓝色的溶液中:Al3+、NO3-、S2-、CO32- | |
| C. | 在加入铝粉能产生H2的溶液中:NH4+、K+、SO42-、NO3- | |
| D. | 在由水电离出的c(OH-)=10-13mol•L-1的溶液中:Na+、Ba2+、Cl-、I- |
| A. | 相同温度下,AgCl在水中的溶解度大于在氯化钠溶液中的溶解度 | |
| B. | 浓FeCl3溶液滴入沸水加热形成红褐色透明液体 | |
| C. | 自然界地表层原生铜矿变成CuSO4溶液向地下层渗透,遇到难溶的ZnS或PbS,慢慢转变为铜蓝(CuS) | |
| D. | 加入少量AgCl固体可以除去氯化钠溶液中的少量硫化钠杂质 |
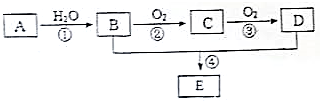 已知A的产量通常用来衡量一个国家的石油化工水平,现以A为主要原料合成一种物质E,其合成路线如图所示.
已知A的产量通常用来衡量一个国家的石油化工水平,现以A为主要原料合成一种物质E,其合成路线如图所示. .B、D分子中的官能团名称分别是羟基、羧基.
.B、D分子中的官能团名称分别是羟基、羧基.