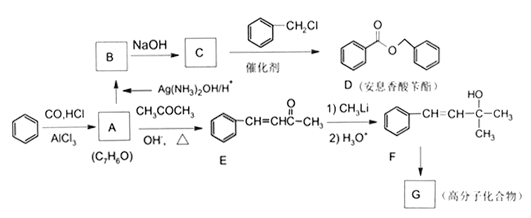
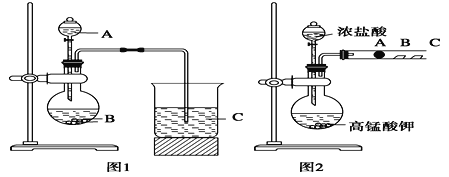
题目内容
【题目】已知:将Cl2通人适量KOH溶液,产物中可能有KC1、KClO、KC1O3,且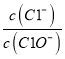 的值与温度高低有关。当n(KOH)=amol时,下列有关说法错误的是
的值与温度高低有关。当n(KOH)=amol时,下列有关说法错误的是
A. 某温度下,若反应后溶液中n(ClO-)=1mol ,n(C1O3-)=2mol,则n(C1-)= 11 mol
B. 参加反应的氯气的物质的量等于0.5amol
C. 上述反应中转移电子的物质的量至少为0.5amol
D. 改变温度,产物中KC1O3的最大理论产量为![]() amol
amol
【答案】D
【解析】A、若某温度下,若反应后溶液中n(ClO-)=1mol ,n(C1O3-)=2mol,根据氧化还原反应中电子转移数目相等可知1×n(C1-)=1×1+5×2,n(C1-)=11mol,选项A正确;B、在反应后产物中K与Cl原子个数比为1:1,因为n(KOH)=amol,所以参加反应的氯气的物质的量等于0.5amol,选项B正确;C、改变温度,若反应后产物完全是KCl、KClO,发生反应:Cl2+2KOH=KCl+KClO+H2O则转移电子的物质的量是0.5amol,则转移电子的物质的量至少为0.5amol,选项C正确。D、改变温度,若完全转化为产物KC1O3,发生反应:3Cl2+6KOH=5KCl+ KClO3+3H2O,则转移电子的物质的量是![]() amol,达到最大值,最大理论产量为
amol,达到最大值,最大理论产量为![]() amol,选项D错误。答案选D。
amol,选项D错误。答案选D。

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案【题目】甲酸乙酯为允许使用的食用香料,又称蚁酸乙酯,有辛辣的刺激味和菠萝样的果香香气,还有强烈朗姆酒似香气,并略带苦味。
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH
②有关有机物的沸点如下
试剂 | 乙醚 | 乙醇 | 甲酸 | 甲酸乙酯 |
沸点(℃) | 34.7 | 78.5 | 100.5 | 54.4 |
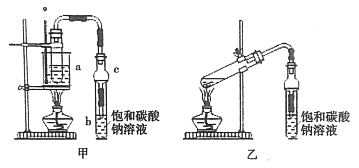
(1)制备粗品
将4mL乙醇、3mL甲酸和2mL浓硫酸加入试管a中,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管b内得到甲酸乙酯的粗品。
①实验时,加入数滴浓硫酸即能起催化作用,但实际用量多于此量,原因是__________;浓硫酸用量又不能过多,原因是_________。
②球形干燥管C的作用是__________。
③若用乙装置制备甲酸乙酯,其缺点有__________。
(2)制备精品
①反应结束后,从试管b中分离出甲酸乙酯粗品所用的主要仪器__________。
②从b中分离出的甲酸乙酯中常含有少量的乙醇、乙醚和水,应先加入无水氯化钙,除去______,然后再通过_________操作得到甲酸乙酯。
③某同学用装有饱和氢氧化钠的试管收集甲酸乙酯,几乎没有收集到产物。原因是______________(用化学方程式解释)。