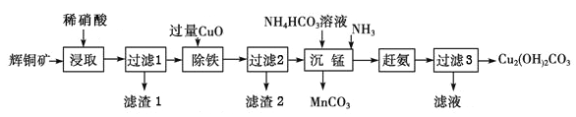
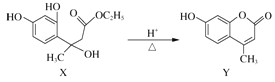
题目内容
【题目】某课外活动小组对“外界条件对铜与稀硝酸反应速率的影响”作了如下探究.
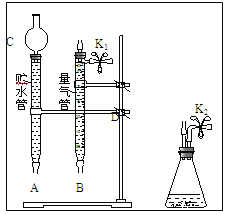
(1)现有以下仪器和用品:橡胶管、秒表、温度计、amol/L稀硝酸、bmol/L稀硝酸及下图中仪器.
①写出本实验的化学方程式,并标出电子转方向和数目:__________________________.
②设计实验方案:在_________________下,测定________________________________.
③在答卷的图中将A、B、C、D、几处用橡胶管以正确方式连接起来,以测定反应所产生气体的体积(三个容器中的液体和水都已画出)_______________.
④测定前,为避免NO被氧化为NO2,要用CO2排出锥形瓶和橡胶管中的空气:在锥形瓶中加入铜片后松开K2弹簧夹,从K2处的橡胶管向装置中通入CO2,此时K1处应进行的操作是____________,则空气已排尽.
(2)注入稀硝酸后,在给定条件下设计实验探究浓度和温度对化学反应速率的影响:温度25℃、50℃;时间t1、t2、t3;收集气体体积V1、V2.请完成下表:____________
实验 | 稀硝酸的浓度/(mol/L) | 稀硝酸的体积/mL | 温度 | 时间 | 收集气体 |
① | a | V | 25 | t1 | V1 |
② | V | ||||
③ | V |
【答案】![]() 相同稀硝酸浓度、不同温度(或相同温度、不同稀硝酸浓度) 相同时间内产生气体体积(或产生相同体积的气体所需的时间)
相同稀硝酸浓度、不同温度(或相同温度、不同稀硝酸浓度) 相同时间内产生气体体积(或产生相同体积的气体所需的时间)  松开K1弹簧夹,接导管通入澄清石灰水至出现白色浑浊为止
松开K1弹簧夹,接导管通入澄清石灰水至出现白色浑浊为止
实验 | 稀硝酸的浓度/(mol/L) | 稀硝酸的体积/mL | 温度 | 时间 | 收集气体 |
① | a | V | 25 | t1 | V1 |
② | b | V | 25 | t1(或t2) | V2(或V1) |
③ | a(或b) | V | 50 | t2(或t1) | V1(或V2) |
(只要组合体现唯一变量、时间同则气体体积不同;时间不同则气体体积相同,均给分)
【解析】
(1)①因铜失去电子,HNO3得到电子,铜作还原剂被氧化,而稀硝酸中的氮元素被还原为NO,化学方程式为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;电子转移方向和数目用单线桥表示为![]() ;
;
②从所给的药品和仪器可知,本实验可以探究硝酸浓度的不同或温度的不同对反应速率的影响,而要探究一个影响因素,则必须保持其他影响因素一致,故若探究硝酸浓度对反应速率的影响,则温度相同,反之,若温度不同,则硝酸浓度相同;测定反应速率的快慢,可以通过测定相同时间内产生气体体积或产生相同体积的气体所需的时间来进行,故答案为:相同稀硝酸浓度、不同温度(或相同温度、不同稀硝酸浓度);相同时间内产生气体体积(或产生相同体积的气体所需的时间);
③根据题意可知,此装置应为排水量气装置,而D为反应的发生装置,生成的气体通过软管进入量气管,将其中的水排出,即量气管起排水量气的作用,排出的水进入贮水管,而贮水管起到贮水的作用,故橡胶软管的应D接C接B接A,故图为: ;
;
④由于量气管起到收集NO的作用,故要将锥形瓶到量气管间的空气排干净,从K2处的橡胶管向装置中通入CO2,松开K1弹簧夹,在K1处接盛有澄清石灰水的烧杯,直到石灰水变浑浊时为止,故答案为:松开K1弹簧夹,接导管通入澄清石灰水至出现白色浑浊为止;
(2)要设计实验探究浓度对化学反应速率的影响,则必须保持其他影响反应速率的影响因素一致,故若②的稀硝酸的浓度为b,则应保持温度与①的相同即25℃,而由于稀硝酸的浓度不同,故反应速率不同,则在相同的时间段内,收集到的其他的体积要不同,即时间为t1,则收集到的气体体积应为V2;或收集相同体积的气体时,所需的时间不同,即收集到的气体体积也为V1,但所需时间为t2;既然①②对比试验探究的是浓度的不同对反应速率的影响,则①③探究的是温度的不同对反应速率的影响,故③中温度应为50℃,则稀硝酸的浓度应为a,而由于温度不同,故反应速率不同,则在相同的时间段内,收集到的其他的体积要不同,即时间为t1,则收集到的气体体积应为V2;或收集相同体积的气体时,所需的时间不同,即收集到的气体体积也为V1,但所需时间为t2,故答案为:
实验 | 稀硝酸的浓度/(mol/L) | 稀硝酸的体积/mL | 温度 | 时间 | 收集气体 |
① | a | V | 25 | t1 | V1 |
② | b | V | 25 | t1(或t2) | V2(或V1) |
③ | a(或b) | V | 50 | t2(或t1) | V1(或V2) |
。

 优学名师名题系列答案
优学名师名题系列答案【题目】水溶液中的离子平衡是中学学习的一个重要内容。
(1)甲同学用pH试纸分别测定了 0.1 mol/L NaOH溶液的pH=13、0.1 mol/LCH3COOH溶液的pH=3、0.001 mol/L HCl溶液的pH=3。请写出pH试纸使用方法:_____根据测量结果,甲推测等浓度的NaOH溶液、CH3COOH溶液中,由水电离出的H+浓度c(H+)NaOH____c(H+)CH3COOH(填“大于”“小于”或“等于”)
(2)乙同学分别取了pH=3的CH3COOH溶液和HCl溶液各10mL,测量导电能力发现HCl溶液导电能力______________CH3COOH溶液导电能力(填“大于”“小于”或“等于”)。然后分别加水稀释到100 mL后,再次测量,稀释后的HCl溶液导电能力______________CH3COOH溶液导电能力(填“大于”“小于”或“等于”)
(3)丙同学查阅资料发现,人体血液里存在重要的酸碱平衡:CO2+H2O![]() H2CO3
H2CO3![]() HCO3-,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO3-)∶c(H2CO3)变化关系如下表:
HCO3-,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO3-)∶c(H2CO3)变化关系如下表:
c(HCO3-) ∶c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
pH | 6.10 | 7.35 | 7.40 | 7.45 |
①正常人体血液中,HCO3-的水解程度____电离程度(填“>”、“<”或“=”);
②人体血液酸中毒时,可注射________(填选项)缓解;
A.NaOH溶液 B.NaHCO3溶液 C.NaCl溶液 D.Na2SO4溶液
③等浓度的Na2CO3和NaHCO3的混合溶液中各离子浓度大小顺序___________
④已知25 ℃时,CO32-水解反应的平衡常数Kh=![]() =
=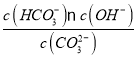 =2×10-4 mol/L,当溶液中c(HCO3-)︰c( CO32-)=2:1时,溶液的pH=________;
=2×10-4 mol/L,当溶液中c(HCO3-)︰c( CO32-)=2:1时,溶液的pH=________;
(4)丁同学探究难溶电解质在水溶液中的性质,查阅资料发现25 ℃时,AgCl的Ksp=1.8×10-10,该温度下向1 L 0.03 mol/L的AgNO3溶液中加入1 L 0.01 mol/L的NaCl溶液之后,溶液中c(Cl-)=______mol/L(忽略混合前后溶液体积的变化)。平衡后,若向该体系中再加入少量AgCl固体,则c(Cl-)_____(填“增大”或“减小”或“span>不变”)。