题目内容
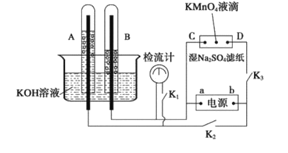
【题目】在下图所示的装置中,试管A、B中的电极为多孔的惰性电极;C、D为两个铂夹,夹在被Na2SO4溶液浸湿的滤纸条上,滤纸条的中部滴有一滴KMnO4;电源有a、b两极。若在A、B中充满0.01 mol/L 的KOH溶液后倒立于同浓度的KOH溶液的水槽中,断开K1,闭合K2、K3,通直流电,实验现象如下图所示,则:
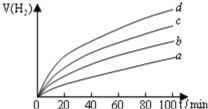
(1)断开K1,闭合K2、K3,通直流电,试管B中产生的气体为_________(填化学式)。
(2)在Na2SO4溶液浸湿的滤纸条中部的KMnO4处现象为_____________。
(3)断开K1,闭合K2、K3,通直流电较长一段时间后,KOH溶液pH变__________(填“变大”“变小”或“不变”)。
(4)电解一段时间后,A、B中均有气体包围电极。此时切断K2、K3,闭合K1,检流计有指数,此时该装置A试管中电极上发生的反应为_____________
【答案】H2 紫色向D处移动 变大 O2+4e- +2H2O=4OH-
【解析】
A、B中电极为多孔的惰性电极;C、D为夹在湿的Na2SO4滤纸条上的铂夹;电源有a、b两极。若在A、B中充满KOH溶液后,倒立于KOH溶液的水槽中,切断K1,闭合K2、K3,通直流电,AB、CD处是电解原理的应用。
(1)依据A、B中气体体积变化分析,电解的是水,A端产生氧气,电解池的阳极;B端产生是氢气,为电解池的阴极,则a为电源的负极,b为电源正极;
(2)C、D为夹在滤纸两端的铂夹,与电源也构成了电解池,C与电源负极相连,为阴极,D与电源正极相连,为阳极,据此解答;
(3)断开K1,闭合K2、K3,通直流电,发生的电解反应,电解KOH溶液实质上是电解水,根据溶液中OH-的浓度与溶液的pH关系分析判断;
(4)若电解一段时间,A、B中均有气体包围电极,此时切断K2、K3,闭合K1,A、B中形成的氢氧燃料电池,依据原电池原理分析判断。
(1)切断K1,合闭K2、K3通直流电,电极A、B及氢氧化钾溶液构成电解池,根据离子的放电顺序,溶液中氢离子、氢氧根离子放电,分别生成氢气和氧气,氢气和氧气的体积比为2:1,通过图象知,B极上气体体积是A极上气体体积的2倍,所以B极上得H2,A极上得到O2,所以B极是阴极,A极是阳极,则a是负极,b是正极;
(2)浸有硫酸钠的滤纸和电极C、D与电源也构成了电解池,因为a是负极,b是正极,所以C是阴极,D是阳极,电解质溶液中的阳离子K+向阴极C电极区域移动,阴离子MnO4-向阳极D区域移动,所以D极附近的溶液呈紫色;
(3)切断K1,合闭K2、K3,电解较长一段时间,A、B中均有气体包围电极,电解KOH溶液,实质上是电解H2O,H2O不断电解消耗,使得KOH的浓度逐渐增大,则溶液中c(OH-)增大,因此一段时间后溶液的pH会变大;
(4)若电解一段时间后,A、B中均有气体包围电极.此时切断K2、K3,闭合K1,构成氢氧燃料电池,在燃料电池中,燃料氢气所在的B电极为负极,失去电子,发生氧化反应,电极反应式为2H2+4OH--4e-=4H2O;氧气所在的A电极为正极,O2获得电子,发生还原反应,电极反应式为O2+2H2O+4e-=4OH-。

 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案【题目】某课外活动小组对“外界条件对铜与稀硝酸反应速率的影响”作了如下探究.
(1)现有以下仪器和用品:橡胶管、秒表、温度计、amol/L稀硝酸、bmol/L稀硝酸及下图中仪器.
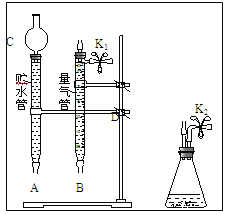
①写出本实验的化学方程式,并标出电子转方向和数目:__________________________.
②设计实验方案:在_________________下,测定________________________________.
③在答卷的图中将A、B、C、D、几处用橡胶管以正确方式连接起来,以测定反应所产生气体的体积(三个容器中的液体和水都已画出)_______________.
④测定前,为避免NO被氧化为NO2,要用CO2排出锥形瓶和橡胶管中的空气:在锥形瓶中加入铜片后松开K2弹簧夹,从K2处的橡胶管向装置中通入CO2,此时K1处应进行的操作是____________,则空气已排尽.
(2)注入稀硝酸后,在给定条件下设计实验探究浓度和温度对化学反应速率的影响:温度25℃、50℃;时间t1、t2、t3;收集气体体积V1、V2.请完成下表:____________
实验 | 稀硝酸的浓度/(mol/L) | 稀硝酸的体积/mL | 温度 | 时间 | 收集气体 |
① | a | V | 25 | t1 | V1 |
② | V | ||||
③ | V |
【题目】I.配制250mL0.5mol/L的NaOH溶液,所需的仪器有烧杯、玻璃棒、托盘天平、胶头滴管和_______。定容时俯视观察刻度线,其结果_______。(填“偏大”、“偏小”、或“不变”)
Ⅱ.实验室用加热固体氯化铵和氢氧化钙的混合物制取氨气,反应的化学方程式是_______;所制得的气体中常含有少量杂质气体,为了得到纯净的氨气并加以检验,请在下列装置或试剂中,根据要求作出合适选择,并将对应选择的装置编号字母填入表中的空格处:
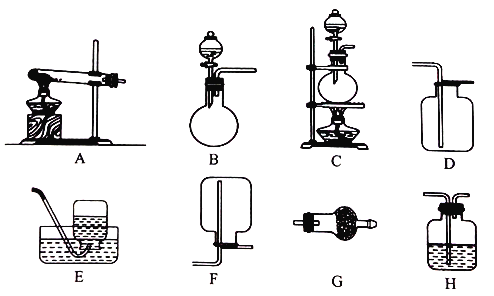
试剂:a. NaOH溶液 b.澄清石灰水 c.浓硫酸 d.饱和NaHCO3溶液 e.碱石灰
f.品红溶液 g.湿润的红色石蕊试纸
制取气体 | 杂质气体 | 制取气体的 发生装置 | 收集装置 | 净化装置中 所用的试剂 | 检验制得的气体 所用试剂 |
NH3 | H2O(g) | _______ | F | e | _______ |
【题目】利用![]() 可消除
可消除![]() 的污染,反应原理为:
的污染,反应原理为:![]() ,在10L密闭容器中分别加入
,在10L密闭容器中分别加入![]() 和
和![]() ,测得不同温度下
,测得不同温度下![]() 随时间变化的有关实验数据如表所示:
随时间变化的有关实验数据如表所示:
组别 | 温度 | 时间 物质的量 | 0 | 10 | 20 | 40 | 50 |
|
|
|
|
|
|
|
|
|
|
|
|
|
| M |
|
下列说法正确的是
A.组别![]() 中
中![]() 内,
内,![]() 降解速率为
降解速率为![]()
B.由实验数据可知温度![]()
C.![]() 时,表格中M对应的数据为
时,表格中M对应的数据为![]()
D.该反应只有在高温下才能自发进行