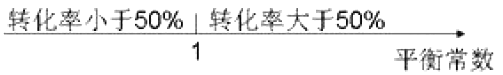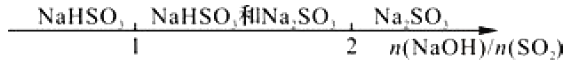题目内容
【题目】煤炭是我国的主要能源之一,与之伴生的二氧化硫(SO2)和酸雨污染问题较为突出。目前我国采用的控制方法是电厂烟气脱硫。烟气脱硫的原理是利用碱性物质吸收并固定酸性的二氧化硫,主要有如下两种方法:
I、钠碱循环法脱硫技术。
(1)此法是利用Na2SO3溶液可脱除烟气中的SO2。Na2SO3可由NaOH溶液吸收SO2制得,该反应的离子方程式: 。
(2)NaOH溶液吸收SO的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
pH | 8.2 | 7.2 | 6.2 |
①由上表判断,NaHSO3溶液显 性,用化学平衡原理解释: 。
②当溶液呈中性时,离子浓度关系正确的是(选填字母): 。
a.c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H-)=c(OH-)
c.c(Na+)=2c(SO32-)+c(HSO3-)
II、石灰石脱硫法
此法是以石灰石为原料通过系列反应将硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g)△H=218.4kJ·mol-1(反应Ⅰ)
CaO(s)+SO2(g)+CO2(g)△H=218.4kJ·mol-1(反应Ⅰ)
CaSO4(s)+4CO(g)![]() CaS(s)+4CO2(g)△H2=-175.6kJ·mol-1(反应Ⅱ)
CaS(s)+4CO2(g)△H2=-175.6kJ·mol-1(反应Ⅱ)
请回答下列问题:
(1)结合反应Ⅰ、Ⅱ写出CaSO4(s)与CaS(s) 的热化学反应方程式 。
(2)对于气体参与的反应,表示平衡常数 Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则反应Ⅰ的Kp= (用表达式表示)。
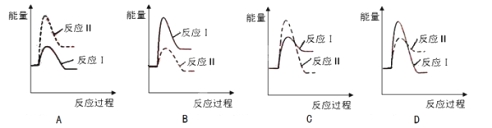
(3)假设某温度下,反应Ⅰ的速率(v1)小于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是 。
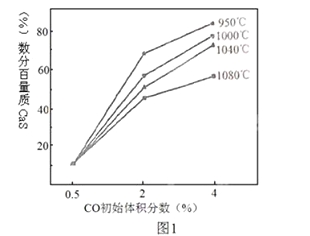
(4)图1为实验测得不同温度下反应体系中CO初始体积百分数与平衡时固体产物中CaS质量百分数的关系曲线。则降低该反应体系中产生的SO2生成量的措施有 。
A、向该反应体系中投入生石灰
B、在合适的温度区间内控制较低的反应温度
C、降低CO的初始体积百分数
D、提高反应体系的温度
/span>
【答案】
Ⅰ、(1)2OH-+SO2═SO32-+H2O;
(2)①酸;溶液中存在HSO3-![]() H++SO32-,HSO3-+H2O
H++SO32-,HSO3-+H2O![]() H2SO3+OH-,显酸性是因其电离大于其水解;②bc;
H2SO3+OH-,显酸性是因其电离大于其水解;②bc;
Ⅱ、(1)3CaSO4(s)+CaS(s)=4CaO(s)+4SO2(g)△H=1049.2kJmol-1;
(2)![]() ;(3)B;(4)AB。
;(3)B;(4)AB。
【解析】
试题分析:Ⅰ、(1)二氧化硫与氢氧化钠反应的离子方程式:2OH-+SO2═SO32-+H2O,故答案为:2OH-+SO2═SO32-+H2O;
(2)①由表格中的数据可知,溶液呈酸性,HSO3-越多,酸性越强,是因为溶液中存在:HSO3-![]() SO32-+H+; HSO3-+H2O
SO32-+H+; HSO3-+H2O![]() H2SO3+OH-电离程度大于水解程度,溶液显酸性,故答案为:酸;溶液中存在HSO3-
H2SO3+OH-电离程度大于水解程度,溶液显酸性,故答案为:酸;溶液中存在HSO3-![]() H++SO32-,HSO3-+H2O
H++SO32-,HSO3-+H2O![]() H2SO3+OH-,显酸性是因其电离大于其水解;
H2SO3+OH-,显酸性是因其电离大于其水解;
②吸收液呈中性时,溶质为亚硫酸钠和亚硫酸氢钠,电离与水解的程度相等,a.由电荷守恒可知,c(H+)+c(Na+)═2c(SO32-)+c(HSO3-)+c(OH-),中性溶液则c(H+)═c(OH-),则c(Na+)═2c(SO32-)+c(HSO3-),c(SO32-)≠c(H2SO3),故a错误;b.SO32-+H2O![]() HSO3-+OH-,HSO3-
HSO3-+OH-,HSO3-![]() H++SO32-,亚硫酸两步水解,则离子浓度为c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-),故b正确;c.由电荷守恒可知,c(H+)+c(Na+)═2c(SO32-)+c(HSO3-)+c(OH-),中性溶液则c(H+)═c(OH-),则c(Na+)═2c(SO32-)+c(HSO3-),故c正确;故答案为:bc;
H++SO32-,亚硫酸两步水解,则离子浓度为c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-),故b正确;c.由电荷守恒可知,c(H+)+c(Na+)═2c(SO32-)+c(HSO3-)+c(OH-),中性溶液则c(H+)═c(OH-),则c(Na+)═2c(SO32-)+c(HSO3-),故c正确;故答案为:bc;
Ⅱ、(1)CaSO4 (s)+CO (g) ![]() CaO(s)+SO2 (g)+CO2 (g)△H=218.4kJmol-1(反应Ⅰ),CaSO4(s)+4CO(g)
CaO(s)+SO2 (g)+CO2 (g)△H=218.4kJmol-1(反应Ⅰ),CaSO4(s)+4CO(g) ![]() CaS(s)+4CO2(g)△H2=-175.6kJmol-1 (反应Ⅱ)根据盖斯定律将反应Ⅰ×4-反应Ⅱ)得:3CaSO4 (s)+CaS(s)=4CaO(s)+4SO2 (g)△H=1049.2kJmol-1,故答案为:3CaSO4 (s)+CaS(s)=4CaO(s)+4SO2 (g)△H=1049.2kJmol-1;
CaS(s)+4CO2(g)△H2=-175.6kJmol-1 (反应Ⅱ)根据盖斯定律将反应Ⅰ×4-反应Ⅱ)得:3CaSO4 (s)+CaS(s)=4CaO(s)+4SO2 (g)△H=1049.2kJmol-1,故答案为:3CaSO4 (s)+CaS(s)=4CaO(s)+4SO2 (g)△H=1049.2kJmol-1;
(2)由题意可知,平衡常数等于气体生成物二氧化硫、二氧化碳浓度幂之积除以气体反应物一氧化氮浓度幂之积,所以反应Ⅰ的Kp=![]() ,故答案为:
,故答案为:![]() ;
;
(3)反应Ⅰ为吸热反应,反应Ⅱ为放热反应,则A、D错误;反应Ⅰ的速率(v1)小于反应Ⅱ的速率(v2),则反应Ⅱ的活化能较小,则C错误、B正确,故答案为:B;
(4)A.向该反应体系中投入生灰石,可使更多的二氧化硫转化为硫酸钙,减少二氧化硫的排放,故A正确;B.由反应Ⅰ可知生成二氧化硫的反应为吸热反应,则低温下不利于生成二氧化硫,则应在合适的温度区间内控制较低的反应温度,故B正确;C.由图象可知,降低CO的初始体积百分数,减小CaS的质量分数,增加二氧化硫的排放,故C错误;D.提高反应体系的温度,不利于二氧化硫的减少,故D错误;故答案为:AB。

 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案【题目】某研究小组设计如图所示实验装置(夹持及控温装置省略),用Cu(NO3)2 3H2O晶体和SOCl2制备少量无水Cu(NO3)2。已知SOC12熔点-l05℃、沸点76℃、遇水剧烈水解生成两种酸性气体。
 .
.
(1)①仪器c的名称是_________________。
②向三颈烧瓶中缓慢滴加SOC12时,需打开活塞_________(选填“a”、“b”或“a 和 b”)。
(2)装置A中Cu(NO3)2 3H2O和SOC12发生反应的化学方程式是________________。
(3)装置B的作用是________________。
(4)实验室以含铁的铜屑为原料制备Cu(NO3)2 3H2O的实验方案如下:
![]()
己知几种离子生成氢氧化物沉淀的pH如下表
开始沉淀的pH | 沉淀完全的pH | |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Cu2+ | 4.2 | 6.7 |
①步骤I中所用稀HNO3稍过量的目的是_____________。
②请补充完整由溶液I制备Cu(NO3)2 3H2O晶体的实验方案:
向溶液I中加入__________,冰水洗涤得到Cu(NO3)2 3H2O晶体。