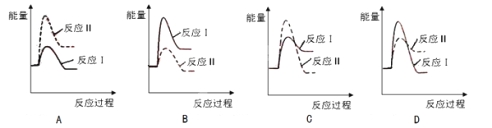
题目内容
【题目】下列说法正确的是:
A. 共价化合物中可能含有离子键
B. 区别离子化合物和共价化合物的方法是看其水溶液是否能够导电
C. 离子化合物中只含有离子键
D. 离子化合物在熔融状态下能电离出自由移动的离子,而共价化合物不能
【答案】D
【解析】A.只含共价键的化合物是共价化合物,含有离子键的化合物为离子化合物,故A错误;B.部分共价化合物在水溶液里能电离出阴阳离子,如HCl在水中能电离,其水溶液能导电,故B错误;C.离子化合物中一定含有离子键,可能含有共价键,如NaOH属于离子化合物,含有O-H共价键,故C错误;D.离子化合物熔融状态能电离,共价化合物在熔融时不电离,只有在水中才能电离,故D正确;故选D。

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案
相关题目
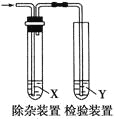
【题目】用下图所示装置检验乙烯时不需要除杂的是 ( )
乙烯的制备 | 试剂X | 试剂Y |
| |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 | |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 | |
C | C2H5OH与浓H2SO4加热至170℃ | 资*源%库NaOH溶液 | KMnO4酸性溶液 | |
D | C2H5OH与浓H2SO4加热至170℃ | NaOH溶液 | Br2的CCl4溶液 |
A. A B. B C. C D. D