题目内容
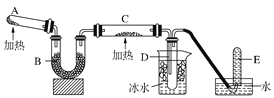
【题目】下图是工业上以天然气、空气为原料合成氨的一种工艺流程:

(1)脱硫反应第一步是利用Fe(OH)3除去H2S,该反应的化学方程式是____________。
(2)脱硫反应第二步是利用空气氧化回收硫,该反应中氧化剂与还原剂的物质的量之比为_________,下列试剂中也适宜作此反应的氧化剂的是________(填选项)。
A.Cl2 B.H2O2 C.KMnO4 D.O3
(3)流程中Fe(OH)3和K2CO3可循环利用,你认为流程中还可循环利用的物质有_______。
(4)合成氨反应的原料气中V(N2)∶V(H2)=1∶3。平衡混合物中氨的含量与温度、压强的关系如下图所示:

则A、B、C三点对应的化学平衡常数KA、KB、KC的关系是___________(用“>”、“<”或“=”表示);A点H2的平衡转化率为________。
【答案】 3H2S + 2Fe(OH)3![]() Fe2S3 + 6H2O 3︰2 B、D N2 和H2 KA>KB =KC 66.7%
Fe2S3 + 6H2O 3︰2 B、D N2 和H2 KA>KB =KC 66.7%
【解析】(1)由流程可知,利用Fe(OH)3与H2S反应生成硫化铁和水从而除去H2S,反应方程式为: 3H2S + 2Fe(OH)3=Fe2S3 + 6H2O;(2)由流程利用空气中氧气氧化硫化铁生成硫单质,氧化剂氧气得4e-,还原剂硫化铁失2×3=6e-,根据得失电子守恒,则氧化剂与还原剂的物质的量之比3:2;因为氯气有毒,KMnO4 会引入新的杂质,所以适宜作此反应的氧化剂的是H2O2和O3,答案选BD;(3)因为合成氨气的反应为可逆反应,不能完全转化,所以除流程中Fe(OH)3和K2CO3可循环利用之外,还可循环利用的物质有N2 和H2;(4)因为平衡常数只随温度变化,图象变化趋势可知随温度升高,氨气含量减小,说明反应逆向进行,所以温度越高平衡常数越小,又A、B、C三点温度为B=C>A,所以A、B、C三点对应的化学平衡常数KA、KB、KC的关系是KA>KB=KC;V(N2):V(H2)=1:3,又A点氨气平衡含量为50%,所以设氮气转化为x,则
N2+3H2![]() 2NH3
2NH3
开始 1 3 0
转化 x 3x 2x
平衡1-x 3-3x 2x
则2x/(1x+33x+2x)×100%=50%,解得x=2/3,所以H2的转化率=2/3×100%=66.7%。

 阅读快车系列答案
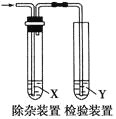
阅读快车系列答案【题目】用下图所示装置检验乙烯时不需要除杂的是 ( )
乙烯的制备 | 试剂X | 试剂Y |
| |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 | |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 | |
C | C2H5OH与浓H2SO4加热至170℃ | 资*源%库NaOH溶液 | KMnO4酸性溶液 | |
D | C2H5OH与浓H2SO4加热至170℃ | NaOH溶液 | Br2的CCl4溶液 |
A. A B. B C. C D. D