题目内容
【题目】Na2CO3、MaHCO3及xNa2CO3·yH2O(过碳酸的)在工农业生产上用途非常广泛。
(1)0.1mol/LNa2CO3溶液加水稀释时,溶液的pH____ (填“增大”、“减小”或“不变”)。
(2)25℃时,H2CO3的电离常数Ka1=5×10-7,Ka=5×10-11,NH3·H2O的电离常数Kb=1.8×10-5,计算下列平衡常数。
①NaHCO3水解反应HCO3-+H2O![]() H2CO3+OH-的平衡常数为K= ________ 。(填数值)
H2CO3+OH-的平衡常数为K= ________ 。(填数值)
②反应HCO3-+NH3·H2O![]() CO32-+NH4++H2O的平衡常数为K=_________。 (填数值)
CO32-+NH4++H2O的平衡常数为K=_________。 (填数值)
(3)一种测定xNa2CO3·yH2O2中y/x值的方法如下:

①滴定CO32-时,终点溶液颜色变化是______。
②滴定H2O2时,MnO4-被还原为Mn2+,反应的离子方程式为_______。
③若消耗盐酸25.00mL,消耗KMnO4溶液19.00mL。y/x的值(列出计算过程)__________。
【答案】 减小 2×10-8 0.09 由黄色变成橙色 2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O n(CO32-)=1/2n(HCl)=1/2×0.1000mol/L×25mL×10-3L/mL=1.25×10-3mol,n(H2O2)=5/2n(KMnO4)=5/2×0.0400mol/L×19mL×10-3L/mL=1.9×10-3mol,y/x=n(H2O2)/n(CO32-)=1.9×10-3mol/(1.25×10-3mol)=1.52
【解析】(1)0.1molL-1Na2CO3溶液加水稀释时,促进碳酸钠水解,溶液中氢氧根离子浓度减小,溶液的pH减小,故答案为:减小;
(2)①NaHCO3水解反应HCO3-+H2OH2CO3+OH-的平衡常数为K= =
= ×
× =
=![]() =
=![]() =2×10-8,故答案为:2×10-8;
=2×10-8,故答案为:2×10-8;
②反应HCO3-+NH3H2OCO32-+NH4++H2O的平衡常数为K= =
= ×
×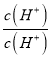 ×
× =
=![]() =
=![]() =0.09,故答案为:0.09;
=0.09,故答案为:0.09;
(3)①称取1,5000g过碳酸钠配制100ml溶液A,分别取A溶液10.00ml,一份加入甲基橙用0.1000mol/L盐酸滴定终点,溶液黄色变化为橙色,故答案为:由黄色变成橙色;
②另一份加入100ml6%的硫酸,用0.0400mol/L高锰酸钾溶液滴定终点,发生氧化还原反应,酸溶液中高锰酸钾溶液氧化过氧化氢生成氧气,反应的离子方程式为:2MnO4-+5H2O2+6H+= 2Mn2++5O2↑+8H2O,故答案为:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O;
③n(CO32-)=![]() n(HCl)=
n(HCl)= ![]() ×0.1000mol/L×25ml×10-3L/ml=1.25×10-3mol,n(H2O2)=
×0.1000mol/L×25ml×10-3L/ml=1.25×10-3mol,n(H2O2)= ![]() n(KMnO4)=
n(KMnO4)= ![]() ×0.0400mol/L×19ml×10-3L/mol=1.9×10-3mol,
×0.0400mol/L×19ml×10-3L/mol=1.9×10-3mol, ![]() =
= =
=![]() =1.52,故答案为:1.52。
=1.52,故答案为:1.52。

 名校课堂系列答案
名校课堂系列答案

