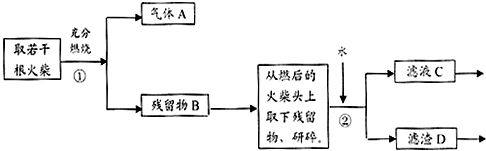
题目内容
3. 钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,被誉为“未来世界的金属”.试回答下列问题:
钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,被誉为“未来世界的金属”.试回答下列问题:(1)钛有${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti两种原子,它们互称为同位素.Ti元素在元素周期表中的位置是第四 周期,第IVB 族;按电子排布Ti元素在元素周期表分区中属于d(填s、p、d、ds或f)区元素
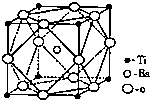
(2)偏钛酸钡在小型变压器、话筒和扩音器中都有应用.偏钛酸钡为离子晶体,晶胞的结构如右图所示,它的化学式是BaTiO3
(3)现有含Ti3+的配合物,化学式为TiCl3(H2O)6,将1mol该物质溶于水,加入足量硝酸银溶液,立即沉淀的氯化银为1mol,已知该配合物的配位数为6,则该配合物的配位体是Cl- 和 H2O.1mol该配合物外界所含结晶水物质的量为2mol.
分析 (1)质子数相同而中子数不同的同种元素的不同原子互为同位素;Ti元素为22号元素,根据核外电子排布确定在周期表中位置;
(2)根据均摊法计算晶胞中各元素原子数目,进而确定化学式;
(3)1molTiCl3(H2O)6溶于水,加入足量硝酸银溶液,立即沉淀的氯化银为1mol,说明在配合物的外界Cl-离子数目为1,作配体的Cl-离子为2,TiCl3(H2O)6中Ti3+的配位数为6,故还有4个H2O作配体,另外2个H2O为结构简式,该配合物化学式为[TiCl2(H2O)4]Cl•2H2O.
解答 解:(1)2248Ti和2250Ti的质子数相同而中子数不同,是钛元素的不同原子,互为同位素,钛元素在周期表中的原子序数为22,基态原子的电子排布式为Is22s22p63S23p63d2 4s2,位于第四周期第IVB族,属于d区元素,故答案为:同位素;四;IVB;d;
(2)晶胞中Ba原子数目为1,Ti原子数目为8×$\frac{1}{8}$,=1,O原子数目为12×$\frac{1}{4}$=3,Ba、Ti、O原子数目中之比为1:1:3,故分子式为:BaTiO3,故答案为:BaTiO3;
(3)1molTiCl3(H2O)6溶于水,加入足量硝酸银溶液,立即沉淀的氯化银为1mol,说明在配合物的外界Cl-离子数目为1,作配体的Cl-离子为2,TiCl3(H2O)6中Ti3+的配位数为6,故还有4个H2O作配体,另外2个H2O为结构简式,该配合物化学式为[TiCl2(H2O)4]Cl•2H2O,1mol该配合物外界所含结晶水物质的量为2mol,故答案为:Cl- 和 H2O;2.
点评 本题是对物质结构的可知,涉及结构与位置关系、元素周期表、晶胞计算、配合物等,难点是配体的判断,注意配合物中内外界的划分,难度中等.

| A. | H2→H2O | B. | Zn→Zn2+ | C. | Fe3+→Fe2+ | D. | CuO→CuCl2 |
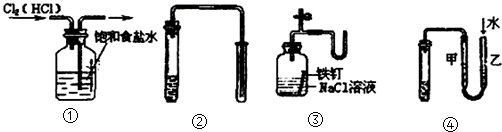
①除去Cl2中的HCl杂质②用铜和稀硝酸制取少量NO③证明铁生锈时空气参与反应④检验装置气密性.
| A. | ①②③④ | B. | ③④ | C. | ②③④ | D. | ①④ |
| A. | 1 mol 任何物质所含的分子数均为NA个 | |
| B. | 14 g氮气所含的N原子数为NA个 | |
| C. | 标准状况下,22.4 L水所含的H2O分子数为NA个 | |
| D. | 在钠与氯气的反应中,1 mol钠失去电子的数目为2 NA个 |
| A. | 三者对应的氧化物均为碱性氧化物 | |
| B. | 三者的单质放置在空气中只生成氧化物 | |
| C. | 制备FeCl3不能采用将溶液直接蒸干的方法 | |
| D. | 电解AlCl3溶液是阴极上析出Al |
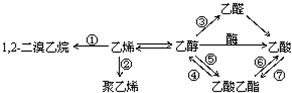
| A. | 反应①是加成反应 | B. | 只有反应②是加聚反应 | ||
| C. | 只有反应⑦是取代反应 | D. | 反应④⑤⑥⑦是取代反应 |
| A. | 用量筒量取一定体积液体时,俯视读出的读数 | |
| B. | 用标准盐酸滴定未知浓度的NaOH溶液,酸式滴定管未用标准盐酸润洗,所测出的碱液的浓度值 | |
| C. | 同一滴定实验,一般要做三次,取三次实验的平均值进行计算,但某同学只做了一次 | |
| D. | 达到滴定终点时,俯视读数 |
| A. |  装置可用于叶绿体中色素的分离 | |
| B. |  装置可用于过滤颗粒很小的沉淀,不宜于过滤胶状沉淀 | |
| C. |  装置可用于某些化学反应速率的测定.该装置气密性的检查如下:仪器组装好后,关闭分液漏斗活塞,将针筒活塞向外拉一段距离,然后松手,观察针筒是否能回到原来刻度处 | |
| D. | 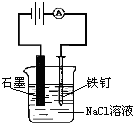 装置不可用来模拟氯碱工业 |