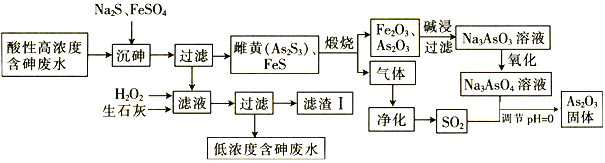
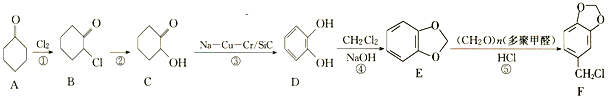
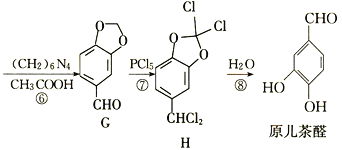
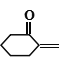
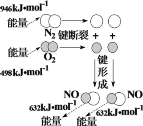题目内容
【题目】化学反应原理在科研和生产中有广泛应用。
(1)用生物质热解气(主要成分为 CO、CH4、H2)将SO2在一定条件下还原为单质硫进行烟 气脱硫。已知:①C(s)+O2(g)=CO2(g)ΔH1= -393.5 kJ·mol-1
②CO2(g)+C(s)=2CO(g) ΔH2= + 172.5 kJ·mol-1
③S(s)+O2(g)=SO2(g) ΔH3= -296.0kJ·mol-1
CO将SO2还原为单质硫的热化学方程式为_______。
(2)CO可用于合成甲醇,一定温度下,向体积为2L的密闭容器中加入CO和H2,发生 反应CO(g)+2H2(g)![]() CH3OH(g),达到平衡后测得各组分的浓度如下:
CH3OH(g),达到平衡后测得各组分的浓度如下:
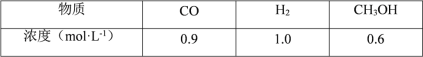
①反应达到平衡时,CO的转化率为_______。
②该反应的平衡常数值 K=_______。
③恒温恒容条件下,可以说明反应已达到平衡状态的是_______(填标号)。
A v 正(CO)=2v 逆(H2) B 混合气体的密度不变
C 混合气体的平均相对分子质量不变 D CH3OH、CO、H2 的浓度都不再发生变化
④若保持容器体积不变,再充入 0.6mol CO 和 0.4mol CH3OH,此时v正_______v逆(填“ >” 、< ”或“= ”)。
(3)在常温下,亚硝酸HNO2的电离常数 Ka=7.1×10-4mol·L-1,NH3·H2O的电离常数 Kb=1.7×10-5mol·L-1。0.1mol·L-1 NH4NO2溶液中离子浓度由大到小的顺序是__________,常温下NO2-水解反应的平衡常数Kh=_______(保留两位有效数字)。
【答案】2CO(g)+SO2(g)=2CO2(g)+S(s) ΔH=-270kJ·mol-1 40% ![]() CD = c(NO2-)>c(NH4+)>c(H+)>c(OH-) 1.4×10-11
CD = c(NO2-)>c(NH4+)>c(H+)>c(OH-) 1.4×10-11
【解析】
(1)根据盖斯定律分析,将几个热化学方程式即反应热进行计算即可;
(2)列出反应的三段式进行分析;
(3)由题知,HNO2的电离常数大于NH3·H2O,则NH4NO2溶液中,NH4+的水解程度大于NO2-的水解程度,则溶液中c(NO2-)>c(NH4+);Kh=![]() 。
。
(1)根据盖斯定律可得,该反应=反应①-反应②-反应③,ΔH=ΔH1-ΔH2-ΔH3,即该反应的热化学方程式为:2CO(g)+SO2(g)=2CO2(g)+S(s) ΔH=-270kJ·mol-1;
(2)该反应的三段式如下:

①α(CO)=![]() =40%;
=40%;
②K=![]() =
=![]() =
=![]() ;
;
③A、平衡时,2v正(CO)=v逆(H2); v正(CO)=2v逆(H2)是某一个点时,体系中的速率关系,且一定不是平衡时的速率关系,故该说法不能说明反应达到平衡,A错误;
B、根据质量守恒定律,反应体系的总质量始终不变,由于该反应是在恒容的容器中进行的,故反应体系的密度始终不变,故该说法不能说明反应达到平衡,B错误;
C、根据质量守恒定律,反应体系的总质量始终不变,但是反应体系的总物质的量在减小,即在反应体系达到平衡之前,反应体系的平均相对分子质量在增大,故当混合气体的平均相对分子质量不再变化时,反应达到平衡,C正确;
D、反应体系的各组分的浓度不再变化时,反应达到平衡,D正确;
故选CD;
④保持容器体积不变,再充入0.6mol CO和0.4mol CH3OH,c(CO)=1.5mol·L-1,c(H2)=1.0mol·L-1,c(CH3OH)=1.0mol·L-1,Qc=![]() =
=![]() =
=![]() =K,则平衡不移动,即v正=v逆;
=K,则平衡不移动,即v正=v逆;
(3)由题知,HNO2的电离常数大于NH3·H2O,则NH4NO2溶液中,NH4+的水解程度大于NO2-的水解程度,故该溶液中各离子浓度由大到小为:c(NO2-)>c(NH4+)>c(H+)>c(OH-);NO2-的水解平衡常数Kh=![]() =
=![]() =
=![]() =
=![]() =1.4×10-11。
=1.4×10-11。

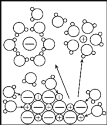
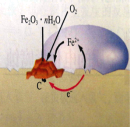
【题目】下列示意图与化学用语表述内容不相符的是(水合离子用相应离子符号表示)
A | B | C | D |
|
|
|
|
NaCl溶于水 | 铁的吸氧腐蚀原理 | 铜锌原电池构造和原理 | N2与O2反应能量变化 |
NaCl=Na+ + Cl- | 负极:Fe - 2e-=Fe2+ | 总反应:Zn + Cu2+=Zn2+ + Cu | N2(g) + O2(g)=2NO(g)ΔH=-180 kJ·mol-1 |
A.AB.BC.CD.D