题目内容
【题目】A、B、C均为中学化学常见的纯净物,它们之间存在如下转化关系:
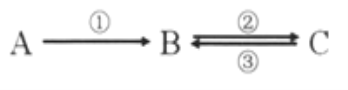
其中①②③均为有单质参与的反应。
(1)若A是常见的金属,①③中均有同一种黄绿色气体参与反应,B溶液遇KSCN显血红色,且②为化合反应,写出反应②的离子方程式_________________________。
(2)如何检验上述C溶液中的阳离子?______________________。
(3)若B是太阳能电池用的光伏材料,①②③为工业制备B的反应。C的化学式是____________,属于置换反应____________,(填序号)写出反应①的化学方程式____________________。
【答案】Fe+2Fe3+=3Fe2+ 取少量溶液于试管,加KSCN溶液,无明显现象,再加氯水,溶液变成血红色,则证明含Fe2+ SiCl4 ① ③ 2C+SiO2![]() Si+2CO↑
Si+2CO↑
【解析】
(1)由转化关系可知A为变价金属,则A应为Fe,B为氯化铁,C为氯化亚铁,②为Fe与氯化铁的反应;
(3)B是太阳能电池用的光伏材料,可知B为Si,①为C与二氧化硅的反应,①②③为工业制备B的反应,则C为SiCl4,③中SiCl4与氢气反应,提纯Si,以此解答该题。
(1)A是常见的金属,①③中均有同一种气态非金属单质参与反应,且②为化合反应,则该非金属气体为Cl2,B为氯化铁,则反应②的离子方程式为2Fe3++Fe=3Fe2+;
(2)由分析知C为氯化亚铁,检验Fe2+的操作方法是取少量溶液于试管,加KSCN溶液,无明显现象,再加氯水,溶液变成血红色,则证明含Fe2+;
(3)B是太阳能电池用的光伏材料,可知B为Si,①为C与二氧化硅的反应,①②③为工业制备B的反应,则C为SiCl4,其中②为Si和Cl2化合生成SiCl4,③中SiCl4与氢气反应,提纯Si,则反应①的化学方程式为SiO2+2C![]() Si+2CO↑,其中属于置换反应的有① ③。
Si+2CO↑,其中属于置换反应的有① ③。



