题目内容
【题目】环戊二烯容易发生聚合生成二聚体,该反应为:2![]()
![]()
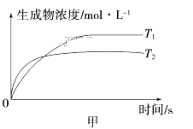
![]() ΔH<0。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法不正确的是
ΔH<0。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法不正确的是

A.T1<T2
B.a点的正反应速率大于b点的逆反应速率
C.达平衡后,T1温度下环戊二烯的浓度大于T2温度下环戊二烯的浓度
D.反应开始至b点时,双环戊二烯平均速率约为:0.45molL-1h-1
【答案】C
【解析】
A.温度越高反应速率越快,根据图示可知,在温度T2(虚线)的反应速率较大,则T1<T2,故A正确;
B.根据图象可知,a点切线斜率的绝对值大于b点切线的绝对值,则a点速率大于b点,故B正确;
C.该反应ΔH<0,是放热反应,由T1<T2,温度降低,平衡正向移动,则T1温度下平衡时环戊二烯的浓度小于T2温度下环戊二烯的浓度,故C错误;
D.b点时环戊二烯的浓度变化为:1.5mol/L-0.6mol/L=0.9mol/L,环戊二烯平均速率约为:![]() ,由化学反应速率比等于化学计量数之比,可得双环戊二烯平均速率约为:
,由化学反应速率比等于化学计量数之比,可得双环戊二烯平均速率约为:![]() ,故D正确;
,故D正确;
答案选C。

【题目】反应CO(g)+2H2(g)![]() 2CH3OH(g)在恒容密闭容器中进行。为探究温度、CO2等因素对该反应的影响,进行了4组实验,结果如右下表。下列说法不正确的是
2CH3OH(g)在恒容密闭容器中进行。为探究温度、CO2等因素对该反应的影响,进行了4组实验,结果如右下表。下列说法不正确的是
组序号 | 1 | 2 | 3 | 4 | |
反应温度/℃ | 225 | 235 | 225 | 235 | |
反应前气体的物质的量/mol | CO2 | 0 | 0 | 0.2 | 0.2 |
CO | 3.0 | 3.0 | 2.8 | 2.8 | |
H2 | 7.0 | 7.0 | 7.0 | 7.0 | |
平衡时CH3OH的体积分数/% | 4.9 | 8.8 | 36.5 | 50.7 | |
A.该反应的△H>0
B.当容器中压强不变时,反应达到平衡
C.CH3OH含量增大的原因是CO2
D.少量CO2能提高平衡时CH3OH的体积分数
【题目】决定物质性质的重要因素是物质结构。请回答下列问题:
(1)已知元素M是组成物质Ca5(PO4)3F的一种元素。元素M的气态原子逐个失去第1个至第5个电子所需能量(即电离能,用符号I1至I5表示)如表所示:
I1 | I2 | I3 | I4 | I5 | |
电离能 | 589.8 | 1145.4 | 4912.4 | 6491 | 8153 |
元素M化合态常见化合价是_________价,其基态原子电子排布式为_________。
(2)Ca3(PO4)3F中非金属元素电负性由大到小的顺序为_________。
(3)PO43-的中心原子的杂化方式为_________,该离子的空间构型为_________,键角为________,其等电子体有_________ (请写出两种)。
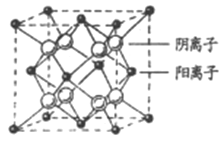
(4)CaF2晶胞结构如图所示,则CaF2晶体中与Ca2+最近且等距离的Ca2+数目为_________;已知Ca2+和F半径分别为a cm、b cm,阿伏加德罗常数为NA,M为摩尔质量,则晶体密度为________g·cm3(不必化简)。
(5)已知MgO与CaO的晶体结构相似,其摩氏硬度的大小关系为_________,原因为___________。