题目内容
4.依据原电池原理将反应CuCl2+Fe=FeCl2+Cu 设计为原电池,请画出实验装置图,注明电解质溶液名称和正负极材料,标出电子流动方向,写出电极反应式.
Cu是正极,正极反应式:Cu2++2e-=Cu
Fe是负极,负极反应式:Fe-2e-=Fe2+.
分析 该原电池反应中,Fe元素化合价由0价变为+2价,所以Fe失电子发生氧化反应,则Fe作负极,Cu元素化合价由+2价变为0价,则氯化铜得电子发生还原反应,Cu为正极,氯化铜溶液为电解质溶液,电子从负极沿导线流向正极,电流与电子流向相反,据此分析解答.
解答 解:该原电池反应中,Fe元素化合价由0价变为+2价,所以Fe失电子发生氧化反应,则Fe作负极,Cu元素化合价由+2价变为0价,则氯化铜得电子发生还原反应,Cu为正极,氯化铜溶液为电解质溶液,电子从负极沿导线流向正极,电流与电子流向相反,正极、负极反应式分别为Cu2++2e-=Cu、Fe-2e-=Fe2+,其装置图为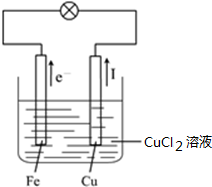 ,
,
故答案为: ;Cu;Cu2++2e-=Cu;Fe;Fe-2e-=Fe2+.
;Cu;Cu2++2e-=Cu;Fe;Fe-2e-=Fe2+.
点评 本题考查原电池设计,为高频考点,明确得失电子与正负极关系是解本题关键,根据元素化合价变化确定正负极,得电子发生还原反应的电解质溶液为原电池电解质溶液,题目难度不大.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
14.下列有关化学实验操作及安全的说法正确的是( )
| A. | 用酒精灯给锥形瓶加热来浓缩溶液 | |
| B. | 实验室不能采用向下排空气法收集CO | |
| C. | 实验室用碳酸钙和稀盐酸反应,气体产物经碱石灰干燥后可得纯净干燥的CO2 | |
| D. | 氢氧化钙溶液存放在配有磨口塞的玻璃瓶中 |
15.下列说法正确的是( )
| A. | 氨的催化氧化是一种特殊的固氮方式 | |
| B. | Na2O、Fe2O3、Al2O3既属于碱性氧化物,又属于离子化合物 | |
| C. | Na2O2晶体中既含有离子键又含有共价键 | |
| D. | 用加热分解的方法可将NH4Cl固体和Ca(OH)2固体的混合物分离 |
12.下列各项操作中不发生先沉淀后溶解现象的是( )
| A. | 向饱和Na2CO3溶液中通入过量CO2 | |
| B. | 向Fe(OH)3胶体中逐滴滴加入过量H2SO4溶液 | |
| C. | 向石灰水中通入过量CO2 | |
| D. | 向NaAlO2溶液中逐滴加入盐酸至过量 |
19.当乙醇分子中的氧原子被硫原子代替后即为乙硫醇(C2H5SH),乙硫醇的沸点为36.2℃,而乙醇(C2H5OH)的沸点为78.4℃.以下能对两者沸点差异作正确解释的是( )
| A. | 相对分子质量的大小 | B. | 共价键的强弱 | ||
| C. | 氢键 | D. | 结构的相似性 |
9.下列物质既能使酸性高锰酸钾溶液褪色,又能使溴水褪色的是( )
| A. | 乙酸乙酯 | B. | 甲烷 | C. | 乙酸 | D. | 植物油 |
14.设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A. | 常温常压下,22.4L氧气所含的原子数为2NA | |
| B. | 17g的OH-离子中含有的电子数为9NA | |
| C. | 常温常压下,44gCO2含有的氧原子数为2NA | |
| D. | 标准状况下,11.2L四氯化碳所含分子数为0.5NA |
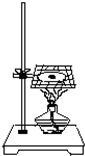 如图所示,将一小块钠放在石棉网上加热.回答下列问题:
如图所示,将一小块钠放在石棉网上加热.回答下列问题: