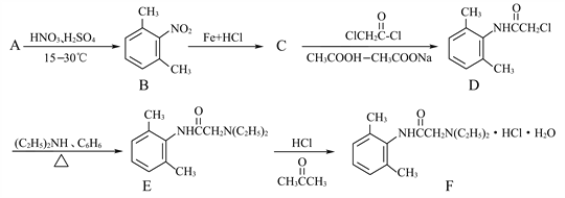
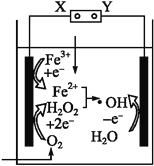
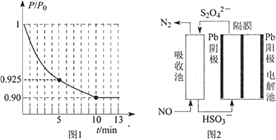
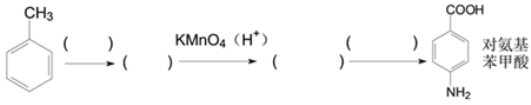��Ŀ����
����Ŀ����֪�缫��ÿͨ��96500 C�ĵ����ͻ���1 mol���ӷ���ת�ơ���ȷ�������������ڶ��Ե缫���ԶƲ���ʽ�����Ľ�������������ȷ����������ͨ�����صĵ�����ʵ�ʲ����У������������ƣ���ͼ��ʾ������˵������ȷ����

A. ��Ҫ�ⶨ��ⱥ��ʳ��ˮʱͨ���ĵ������ɽ������������е������������ص��������������������Դ�ĸ���������
B. �������ǰ�������������仯���ý������ij�����Ϊ108.0 mg�����������ͨ�����صĵ���Ϊ96.5 C
C. ʵ���У�Ϊ�˱������ܽ�����п��ܲ����Ľ����������������������²������������缫��������һ���ռ���������û���ռ����������������ƫ�ߡ�
D. �������е�����Ӧ���Դ�����������������������ĵ缫��Ӧ�ǣ�Ag+ + e- = Ag
���𰸡�A
���������õ������൱�ڲ��϶��������Ը����������е������������ص��������������������Դ�ĸ�����������A��������Ag�����ʵ���Ϊ![]() ������Ag++e-=Ag��֪ͨ���ĵ������ʵ���Ϊ0.001mol��ͨ������Ϊ96.5C����B��ȷ�����ܽ�ʱ��Щ��ԭ�ӿ���δʧ���ӱ�������ӣ�����ֱ�ӵ��䵽�������У���ɲ��������ؽ϶࣬���¼�����ĵ���ƫ�����Ա��������ռ�������C��ȷ���õ������൱�ڲ��϶�����������Pt����Ag++e-�TAg����D��ȷ��
������Ag++e-=Ag��֪ͨ���ĵ������ʵ���Ϊ0.001mol��ͨ������Ϊ96.5C����B��ȷ�����ܽ�ʱ��Щ��ԭ�ӿ���δʧ���ӱ�������ӣ�����ֱ�ӵ��䵽�������У���ɲ��������ؽ϶࣬���¼�����ĵ���ƫ�����Ա��������ռ�������C��ȷ���õ������൱�ڲ��϶�����������Pt����Ag++e-�TAg����D��ȷ��

 ������ÿ�ʱ��ҵϵ�д�
������ÿ�ʱ��ҵϵ�д�����Ŀ������������ֳ�Ī���Σ���dz��ɫ���壮���ڿ����б�һ���������ȶ����dz��õ�Fe2+�Լ���ijʵ��С�����ù�ҵ����м��ȡĪ���Σ����ⶨ�䴿�ȣ�
��֪����
| 10 | 20 | 30 | 40 | 50 | 70 |
��NH4)2SO4 | 73.3 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
FeSO47H2O | 40.0 | 48.0 | 60.0 | 73.3 | �� | �� |
��NH4��2SO4FeSO46H2O | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
��Ī�������Ҵ��ܼ������ܣ�
����Ī���ε���ȡ

�Է�����
��1����������м����ʣ��ʱ���й��ˣ���ԭ����______________________��
��2������3�а�����ʵ���������_____________________��
��3����ƷĪ���������______________________ ϴ�ӣ�����ĸ��ţ���
a������ˮ b���Ҵ� c����Һ
��Ϊ�ⶨ��������泥�NH4��2SO4FeSO46H2O���崿�ȣ�ijѧ��ȡm g�����������Ʒ���Ƴ�500mL��Һ������������ɼס��ҡ�����λͬѧ�������������ʵ�鷽������ش�
����һ��ȡ20.00mL�����������Һ��0.1000molL��1������KMnO4��Һ�����ν��еζ���
��������ȡ20.00mL�����������Һ��������ʵ�飮
![]()
��4����ʵ���������ȷ��������һ�IJⶨ�������С�ڷ������������ԭ��Ϊ_________����֤�Ʋ�ķ���Ϊ��___________________________________________����������ͨ��NH4+�ⶨ��ʵ�����ͼ������ʾ��ȡ20.00mL�����������Һ���и�ʵ�飮

��5��װ��___________ ����ס����ҡ�����Ϊ�������ж�������_______________��
��6��������������Լ���__________ ������ĸ��ţ���ѡ���ҡ�����˿գ���ѡ���ס��˿տɲ����
a��ˮ b������NaHCO3��Һ c��CCl4
��7�������NH3�����ΪV L��������Ϊ��״���£��������������茶���Ĵ���Ϊ_______��