题目内容
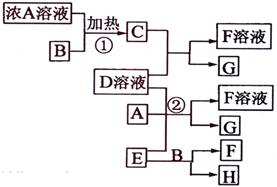
 有关物质存在如图所示的转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质.实验室中,常用固体E在B的催化下加热制取气体单质H.
有关物质存在如图所示的转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质.实验室中,常用固体E在B的催化下加热制取气体单质H.(1)反应①的离子方程式为
MnO2+4H++2Cl-=Cl2↑+Mn2++2H2O
MnO2+4H++2Cl-=Cl2↑+Mn2++2H2O
(2)反应②的离子方程式为
6I-+ClO-3+6H+=3I2+Cl-+3H2O
6I-+ClO-3+6H+=3I2+Cl-+3H2O
(3)写出另外一种实验室制取H的化学方程式
2H2O2
2H2O+O2↑或2KClO3
2KCl+O2↑
| ||
| △ |
| ||
| △ |
2H2O2
2H2O+O2↑或2KClO3
2KCl+O2↑
.
| ||
| △ |
| ||
| △ |
分析:G为紫黑色固体单质,则G为I 2,C为气体单质,则C具有氧化性,D中含有I-,C由浓A溶液与B在加热下生成,有B在制取气体H中做催化剂,推出B应为MnO 2,则A为HCl,C为Cl 2,实验室中用MnO2催化制取的气体是O 2,即H为O 2,E为固体,则E是KClO 3,所以F为KCl,在酸性条件下KClO 3可以将I-氧化为I 2,
要明确常见气体的实验室制法,在气体的制法,哪种物质既可以做催化剂有可以做反应物;在书写氧化还原反应的离子方程式时,配平顺序为:得失电子守恒、电荷守恒、原子守恒.
要明确常见气体的实验室制法,在气体的制法,哪种物质既可以做催化剂有可以做反应物;在书写氧化还原反应的离子方程式时,配平顺序为:得失电子守恒、电荷守恒、原子守恒.
解答:解;G为紫黑色固体单质,则G为I 2,C为气体单质,则C具有氧化性,D中含有I-,C由浓A溶液与B在加热下生成,有B在制取气体H中做催化剂,推出B应为MnO 2,则A为HCl,C为Cl 2,
(1)①为MnO2和浓盐酸在加热条件下反应制备氯气,反应的离子方程式为MnO2+4H++2Cl-
Cl2↑+Mn2++2H2O,
故答案为:MnO2+4H++2Cl-
Cl2↑+Mn2++2H2O;
(2)实验室中用MnO2催化制取的气体是O 2,即H为O 2,E为固体,则E是KClO 3,所以F为KCl,在酸性条件下KClO 3可以将I-氧化为I 2,反应中有H+参加,结合氧原子生成水,反应的离子方程式为6I-+ClO-3+6H+=3I2+Cl-+3H2O,
故答案为:6I-+ClO-3+6H+=3I2+Cl-+3H2O;
(3)实验室制取氧气还可以用过氧化氢分解或氯酸钾加热分解,反应的方程式为2H2O2
2H2O+O2↑
或2KClO3
2KCl+O2↑,
故答案为:2H2O2
2H2O+O2↑或2KClO3
2KCl+O2↑.
(1)①为MnO2和浓盐酸在加热条件下反应制备氯气,反应的离子方程式为MnO2+4H++2Cl-
| ||
故答案为:MnO2+4H++2Cl-
| ||
(2)实验室中用MnO2催化制取的气体是O 2,即H为O 2,E为固体,则E是KClO 3,所以F为KCl,在酸性条件下KClO 3可以将I-氧化为I 2,反应中有H+参加,结合氧原子生成水,反应的离子方程式为6I-+ClO-3+6H+=3I2+Cl-+3H2O,
故答案为:6I-+ClO-3+6H+=3I2+Cl-+3H2O;
(3)实验室制取氧气还可以用过氧化氢分解或氯酸钾加热分解,反应的方程式为2H2O2
| ||
| △ |
或2KClO3
| ||
| △ |
故答案为:2H2O2
| ||
| △ |
| ||
| △ |
点评:本题主要考查卤素机器化合物间的关系及有关离子方程式的书写,试题由一定难度,特别是书写离子方程式,要注意介质的影响

练习册系列答案
相关题目
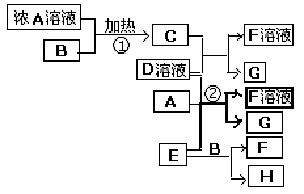
 (2009?海南)有关物质存在如图所示的转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质.实验室中,常用固体E在B的催化下加热制取气体单质H.
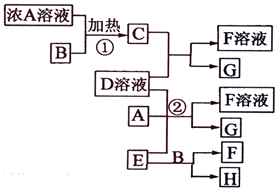
(2009?海南)有关物质存在如图所示的转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质.实验室中,常用固体E在B的催化下加热制取气体单质H.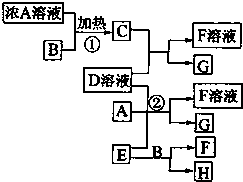 (2012?梧州模拟)有关物质存在如图所示的转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质.实验室中,常用固体E在B的催化下加热制取气体单质H.请回答下列问题:
(2012?梧州模拟)有关物质存在如图所示的转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质.实验室中,常用固体E在B的催化下加热制取气体单质H.请回答下列问题: