题目内容
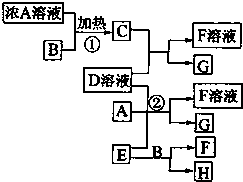 (2012?梧州模拟)有关物质存在如图所示的转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质.实验室中,常用固体E在B的催化下加热制取气体单质H.请回答下列问题:
(2012?梧州模拟)有关物质存在如图所示的转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质.实验室中,常用固体E在B的催化下加热制取气体单质H.请回答下列问题:(1)实验室检验C气体的操作是
将湿润的淀粉碘化钾试纸贴在玻璃棒上,伸入集气瓶中,若试纸变蓝,证明为氯气
将湿润的淀粉碘化钾试纸贴在玻璃棒上,伸入集气瓶中,若试纸变蓝,证明为氯气
(2)反应②的离子方程式为
6I-+ClO3-+6H+═3I2+Cl-+3H2O
6I-+ClO3-+6H+═3I2+Cl-+3H2O
.(3)验证D中阳离子的方法为
焰色反应
焰色反应
,从C与D反应后的混和溶液中提取G的试剂为四氯化碳或苯等
四氯化碳或苯等
(4)若用惰性电极电解F溶液,其阳极的电极反应为
2Cl--2e-═Cl2↑
2Cl--2e-═Cl2↑
(5)D溶液与Pb(NO3)2溶液混合可形成沉淀,此沉淀的Ksp=7.0×10-9.将等体积的D溶液与Pb(NO3)2溶液混合,若D的浓度为1×10-2mol/L,则生成沉淀所需Pb(NO3)2溶液的最小浓度为
5.6×10-4mol?L-1
5.6×10-4mol?L-1
.分析:G为紫黑色固体单质,则G为I 2,C为气体单质,则C具有氧化性,D中含有I-,C由浓A溶液与B在加热下生成,有B在制取气体H中做催化剂,推出B应为MnO 2,则A为HCl,C为Cl 2,实验室中用MnO2催化制取的气体是O 2,即H为O 2,E为固体,则E是KClO3,所以F为KCl,在酸性条件下KClO 3可以将I-氧化为I2,结合元素化合物的性质和题目要求可解答该题.
解答:解:G为紫黑色固体单质,则G为I 2,C为气体单质,则C具有氧化性,D中含有I-,C由浓A溶液与B在加热下生成,有B在制取气体H中做催化剂,推出B应为MnO 2,则A为HCl,C为Cl 2,实验室中用MnO2催化制取的气体是O 2,即H为O2,E为固体,则E是KClO3,所以F为KCl,在酸性条件下KClO 3可以将I-氧化为I2;
分析由图判断得到各物质为:A为盐酸,B为MnO2,C为氯气,D为KI,E为KClO3,F为KCl,G为I2,H为氧气.
(1)C为Cl2,依据氯气的氧化性用湿润的淀粉碘化钾试纸检验,步骤是将湿润的淀粉碘化钾试纸贴在玻璃棒上,伸入集气瓶中,若试纸变蓝,证明为氯气;
故答案为:将湿润的淀粉碘化钾试纸贴在玻璃棒上,伸入集气瓶中,若试纸变蓝,证明为氯气;
(2)反应②是KI、KClO3与浓盐酸的反应,在酸性条件下KClO 3可以将I-氧化为I2,
反应的离子方程式为6I-+ClO3-+6H+═3I2+Cl-+3H2O,
故答案为:6I-+ClO3-+6H+═3I2+Cl-+3H2O;
(3)D为KI,检验阳离子K+需要用焰色反应进行验证,火焰隔着钴玻璃呈紫色;从C为Cl2与D为KI反应后生成碘单质,反应后的混和溶液中提取G为I2的试剂是利用萃取分液的方法分离,选择不溶于水的有机溶剂把碘单质溶解于有机溶剂中分液提取;
故答案为:焰色反应,四氯化碳或苯等
(4)若用惰性电极电解F为KCl溶液,其阳极上是溶液中氯离子失电子生成氯气,反应的电极反应为2Cl--2e-═Cl2↑;
故答案为:2Cl--2e-═Cl2↑
(5)根据题意,沉淀必是PbI2,混合后,c(I-)=5×10-3mol/L,根据Ksp=c[Pb(NO3)2]?c2(I-),则生成沉淀时,混合溶液中的Pb(NO3)2溶液的最小浓度为
=2.8×10-4(mol/L),混合前,即原Pb(NO3)2溶液的最小浓度为2×2.8×10-4mol/L=5.6×10-4mol/L.
故答案为:5.6×10-4mol/L;
分析由图判断得到各物质为:A为盐酸,B为MnO2,C为氯气,D为KI,E为KClO3,F为KCl,G为I2,H为氧气.
(1)C为Cl2,依据氯气的氧化性用湿润的淀粉碘化钾试纸检验,步骤是将湿润的淀粉碘化钾试纸贴在玻璃棒上,伸入集气瓶中,若试纸变蓝,证明为氯气;
故答案为:将湿润的淀粉碘化钾试纸贴在玻璃棒上,伸入集气瓶中,若试纸变蓝,证明为氯气;
(2)反应②是KI、KClO3与浓盐酸的反应,在酸性条件下KClO 3可以将I-氧化为I2,
反应的离子方程式为6I-+ClO3-+6H+═3I2+Cl-+3H2O,
故答案为:6I-+ClO3-+6H+═3I2+Cl-+3H2O;
(3)D为KI,检验阳离子K+需要用焰色反应进行验证,火焰隔着钴玻璃呈紫色;从C为Cl2与D为KI反应后生成碘单质,反应后的混和溶液中提取G为I2的试剂是利用萃取分液的方法分离,选择不溶于水的有机溶剂把碘单质溶解于有机溶剂中分液提取;
故答案为:焰色反应,四氯化碳或苯等
(4)若用惰性电极电解F为KCl溶液,其阳极上是溶液中氯离子失电子生成氯气,反应的电极反应为2Cl--2e-═Cl2↑;
故答案为:2Cl--2e-═Cl2↑
(5)根据题意,沉淀必是PbI2,混合后,c(I-)=5×10-3mol/L,根据Ksp=c[Pb(NO3)2]?c2(I-),则生成沉淀时,混合溶液中的Pb(NO3)2溶液的最小浓度为
| 7.0×10-9 |
| (5×10-3)2 |
故答案为:5.6×10-4mol/L;
点评:本题考查元素化合物的推断,题目难度中等,本题涉及氧化还原反应原理、溶度积等的计算具有一定的综合性,注意根据物质的特性作为该推断题的突破口.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
 (2012?梧州模拟)向10.00mL 0.01mol/L某一元酸HA溶液中逐滴加入0.01mol/L NaOH 溶液,溶液pH变化曲线如图示.下列说法不正确的是( )
(2012?梧州模拟)向10.00mL 0.01mol/L某一元酸HA溶液中逐滴加入0.01mol/L NaOH 溶液,溶液pH变化曲线如图示.下列说法不正确的是( ) (2012?梧州模拟)按如图所示装置进行下列不同的操作,其中不正确的是( )
(2012?梧州模拟)按如图所示装置进行下列不同的操作,其中不正确的是( )