题目内容
6.若NA代表阿伏加德罗常数.下列叙述中正确的是( )| A. | 2.4g金属镁全部变成镁离子时失去的电子数为0.1NA | |
| B. | 1.0 mol任何单质气体的分子数均为NA,原子数均为2NA | |
| C. | 17gNH3所含的电子数目为NA | |
| D. | 16g 02和03混合气体中.含有原子数为NA |
分析 A.镁为+2价金属,2.4g镁的物质的量为0.1mol,完全反应变成镁离子失去0.2mol电子;
B.稀有气体为单原子分子,臭氧为3原子分子;
C.氨气分子中含有10个电子,17g氨气的物质的量为1mol,含有10mol电子;
D.氧气和臭氧都只含有氧原子,16g二者的混合物中含有16g氧原子,含有氧原子的物质的量为1mol.
解答 解:A.2.4g金属镁的物质的量为:$\frac{2.4g}{24g/mol}$=0.1mol,0.1mol镁全部变成镁离子时失去0.2mol电子,失去的电子数为0.2NA,故A错误;
B.1.0 mol任何单质气体的分子数均为NA,但是含有的原子数均为不一定为2NA,如1mol臭氧含有3mol氧原子,1mol稀有气体含有1mol原子,故B错误;
C.17gNH3的物质的量为:$\frac{17g}{17g/mol}$=1mol,1mol氨气中含有10mol电子,含有的电子数目为10NA,故C错误;
D.16g02和03混合气体中含有16个O,含有1mol氧原子,含有原子数为NA,故D正确;
故选D.
点评 本题考查阿伏加德罗常数的综合应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系;有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
17.下列有关14g N2的说法正确的是( )
| A. | 体积为11.2L | B. | 物质的量为0.5mol | ||
| C. | 含有6.02×1023个分子 | D. | 与1g H2的体积一定相同 |
14.下列叙述中,正确的是( )
| A. | 标准状况下,22.4L水所含的原子数目为3NA | |
| B. | 一定条件下,等物质的量甲烷和一氧化碳所含的分子数可能不相等 | |
| C. | 1L一氧化碳气体一定比1L氧气的质量小 | |
| D. | 标准状况下,17g氨气的体积约为22.4L |
1.下列有关摩尔的使用正确的是( )
| A. | 1mol O的质量为16g•mol-1 | |
| B. | 1mol He约含有6.02×1023个原子 | |
| C. | 2H既表示2个氢原子,又表示2mol氢原子 | |
| D. | 1mol HCl约含有6.02×1023个原子 |
2.S2Cl2是一种金黄色易挥发的液体,常用作橡胶硫化剂.某化学兴趣小组 拟设计实验制备少量的S2Cl2,査阅资料知S2Cl2在水中易发生歧化反应(一部分硫元素化 合价升高,另一部分化合价降低).加热条件下硫单质和干燥、纯净的Cl2反应即可生成S2Cl2,反应的化学方程式为:2S+Cl2$\frac{\underline{\;95~100℃\;}}{\;}$S2Cl2.
反应涉及的几种物质的熔沸点如下:
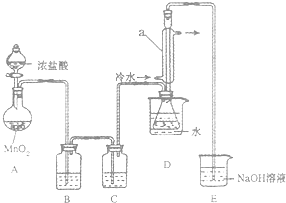 该小组设计的制备装置如图(夹持仪器已略去),回答下列问题:
该小组设计的制备装置如图(夹持仪器已略去),回答下列问题:
(1)连接好实验装置后的第一步实验操作是检查装置的气密性.
(2)实验中需要加热的仪器是AD.(填写字母)
(3)装置B、C中的试剂分别是饱和食盐水、浓硫酸.
(4)装置D中仪器a的作用是冷凝回流、导气.
(5)反应结束后从锥形瓶内混合物中分离出产品的方法是蒸馏.
(6)若实验过程中缺少C装置,发现产品浑浊不清,请用化学方程式表示其原因2S2Cl2+2H2O=3S↓+SO2↑+4HCl↑
(7)实验完毕,小组中的一位同学把剩余浓盐酸倒入E烧杯中,发现有黄绿色剌激性气 体产生.用离子方程式表示产生该现象的原因ClO-+2H++Cl-=Cl2↑+H2O.
反应涉及的几种物质的熔沸点如下:
| 物质 | S | S2Cl2 |
| 沸点/℃ | 445 | 138 |
| 熔点/℃ | 113 | -76 |
 该小组设计的制备装置如图(夹持仪器已略去),回答下列问题:
该小组设计的制备装置如图(夹持仪器已略去),回答下列问题:(1)连接好实验装置后的第一步实验操作是检查装置的气密性.
(2)实验中需要加热的仪器是AD.(填写字母)
(3)装置B、C中的试剂分别是饱和食盐水、浓硫酸.
(4)装置D中仪器a的作用是冷凝回流、导气.
(5)反应结束后从锥形瓶内混合物中分离出产品的方法是蒸馏.
(6)若实验过程中缺少C装置,发现产品浑浊不清,请用化学方程式表示其原因2S2Cl2+2H2O=3S↓+SO2↑+4HCl↑
(7)实验完毕,小组中的一位同学把剩余浓盐酸倒入E烧杯中,发现有黄绿色剌激性气 体产生.用离子方程式表示产生该现象的原因ClO-+2H++Cl-=Cl2↑+H2O.
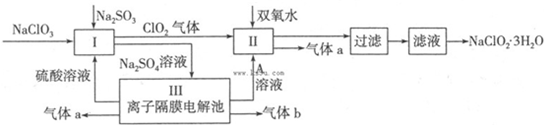
9.在自来水消毒和工业上砂糖、油脂的漂白与杀菌过程中,亚氯酸钠(NaClO2)发挥着重要的作用.下图是生产亚氯酸钠的工艺流程图:
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O;
②常温下,Ksp(FeS)=6.3×10-18;Ksp(CuS)=6.3×10-28;Ksp(PbS)=2.4×10-28
(1)反应I中发生反应的离子方程式为SO32-+2ClO3-+2H+=2C1O2+SO42-+H2O.
(2)从滤液中得到NaClO2•3H2O晶体的所需操作依次是bdc(填写序号).
a.蒸馏 b.蒸发浓缩 c.过滤 d.冷却结晶 e.灼烧
(3)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2.下表是25℃时HClO2及几种常见弱酸的电离平衡常数:
①常温下,物质的量浓度相等的NaClO2、NaF、NaHCO3、Na2S四种溶液的pH由大到小的顺序为pH(Na2S)>pH(NaHCO3)>pH(NaF)>pH(NaClO2) (用化学式表示);体积相等,物质的量浓度相同的NaF、NaClO2两溶液中所含阴阳离子总数的大小关系为:后者大(填“前者大”“相等”或“后者大”).
②Na2S是常用的沉淀剂.某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+离子,滴加Na2S溶液后首先析出的沉淀是CuS;常温下,当最后一种离子沉淀完全时(该离子浓度为10-5mol•L-1)此时体系中的S2-的浓度为6.3×10-13mol/L.
(4)Ⅲ装置中生成气体a的电极反应式2H2O-4e-=O2↑+4H+,若生成气体a的体积为1.12L(标准状况),则转移电子的物质的量为0.2mol.

已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O;
②常温下,Ksp(FeS)=6.3×10-18;Ksp(CuS)=6.3×10-28;Ksp(PbS)=2.4×10-28
(1)反应I中发生反应的离子方程式为SO32-+2ClO3-+2H+=2C1O2+SO42-+H2O.
(2)从滤液中得到NaClO2•3H2O晶体的所需操作依次是bdc(填写序号).
a.蒸馏 b.蒸发浓缩 c.过滤 d.冷却结晶 e.灼烧
(3)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2.下表是25℃时HClO2及几种常见弱酸的电离平衡常数:
| 弱酸 | HClO2 | HF | H2CO3 | H2S |
| Ka/mol•L-1 | 1×10-2 | 6.3×10-4 | K1=4.30×10-7 K2=5.60×10-11 | K1=9.1×10-8 K2=l.1×10-12 |
②Na2S是常用的沉淀剂.某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+离子,滴加Na2S溶液后首先析出的沉淀是CuS;常温下,当最后一种离子沉淀完全时(该离子浓度为10-5mol•L-1)此时体系中的S2-的浓度为6.3×10-13mol/L.
(4)Ⅲ装置中生成气体a的电极反应式2H2O-4e-=O2↑+4H+,若生成气体a的体积为1.12L(标准状况),则转移电子的物质的量为0.2mol.
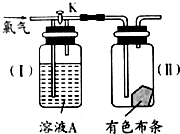 如图是一组探究氯气性质的装置.
如图是一组探究氯气性质的装置.
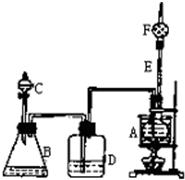 如图是某校化学课外活动小组设计的乙醇与氢卤酸反应的实验装置图.在烧瓶A中放一些新制的无水CuSO4粉末,并加入约20mL无水乙醇;锥形瓶B中盛放浓盐酸;分液漏斗C和广口瓶D中均盛浓H2SO4;干燥管F中填满碱石灰;烧杯作水浴器.当打开分液漏斗C的活塞后,浓H2SO4缓缓流入B中,D中导管口有气泡产生.过几分钟后,无水CuSO4变蓝,此时水浴加热,点燃F管口的气体,观察到绿色的火焰.试回答:
如图是某校化学课外活动小组设计的乙醇与氢卤酸反应的实验装置图.在烧瓶A中放一些新制的无水CuSO4粉末,并加入约20mL无水乙醇;锥形瓶B中盛放浓盐酸;分液漏斗C和广口瓶D中均盛浓H2SO4;干燥管F中填满碱石灰;烧杯作水浴器.当打开分液漏斗C的活塞后,浓H2SO4缓缓流入B中,D中导管口有气泡产生.过几分钟后,无水CuSO4变蓝,此时水浴加热,点燃F管口的气体,观察到绿色的火焰.试回答: