题目内容
在一密闭容器中通入一定量SO2和O2两种气体,在一定条件下反应:2SO2(气)+O2(气)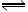 2SO3(气);△H<0,当达到平衡后,改变一个条件(x),下列量(y)一定符合图中曲线的是: ( )
2SO3(气);△H<0,当达到平衡后,改变一个条件(x),下列量(y)一定符合图中曲线的是: ( )
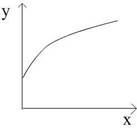
 2SO3(气);△H<0,当达到平衡后,改变一个条件(x),下列量(y)一定符合图中曲线的是: ( )
2SO3(气);△H<0,当达到平衡后,改变一个条件(x),下列量(y)一定符合图中曲线的是: ( )
| A.x为压强,y为SO2的浓度; |
| B.x为温度,混合气体平均相对分子质量; |
| C.x为加入SO2的量,y为O2的转化率; |
| D.x为改变容器的体积,y为SO3的百分含量; |
C
A压强越大,平衡正向移动,SO2的浓度减小;B温度越高,平衡向吸热的逆反应方向移动,气体的量增大,平均相对分子质量减小;D容器体积增大,平衡逆向移动,SO3的百分含量减小。

练习册系列答案
相关题目
 CH3OH(g);CO的转化率(α)与温度、压强的关系如下图所示。
CH3OH(g);CO的转化率(α)与温度、压强的关系如下图所示。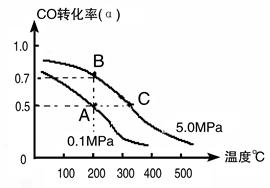
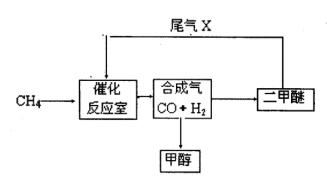
 (2)尾气循环中涉及到以下反应:CH4(g)+H2O(g) CO(g)+3H2(g),请写出某温度下该反应的平衡常数表达式 。
(2)尾气循环中涉及到以下反应:CH4(g)+H2O(g) CO(g)+3H2(g),请写出某温度下该反应的平衡常数表达式 。 反应Ⅰ: CO(g)+2H2(g) CH3OH(g)
反应Ⅰ: CO(g)+2H2(g) CH3OH(g) 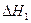
 反应Ⅱ:CO2(g)+3H2(g) CH3(g)+H2O(g)
反应Ⅱ:CO2(g)+3H2(g) CH3(g)+H2O(g)
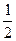 O2(g)
O2(g)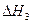 =-192.9kJ·mol-1
=-192.9kJ·mol-1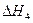 =-241.8kJ·mol-1
=-241.8kJ·mol-1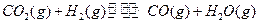 ,达到最大限度时有90%(体积分数)的氢气转化为水,且知在该状态下存在关系
,达到最大限度时有90%(体积分数)的氢气转化为水,且知在该状态下存在关系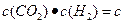
 。则混合气体中二氧化碳和氢气的体积比为( )
。则混合气体中二氧化碳和氢气的体积比为( ) xC(g),2min时反应达到平衡状态(温度不变),此时容器内剩余了0.8molB,并测得C的浓度为0.4mol/L。请填写下列空白:
xC(g),2min时反应达到平衡状态(温度不变),此时容器内剩余了0.8molB,并测得C的浓度为0.4mol/L。请填写下列空白: 3Y(g)+Z(g),达到平衡时,有30%的X发生分解,则平衡时混合气体总的物质的量是( )
3Y(g)+Z(g),达到平衡时,有30%的X发生分解,则平衡时混合气体总的物质的量是( ) 2B(g),2B(g)
2B(g),2B(g) 2NO + O2,达到平衡时,气体体积变为1.2 L,则平衡时NO2的转化率为( )
2NO + O2,达到平衡时,气体体积变为1.2 L,则平衡时NO2的转化率为( )