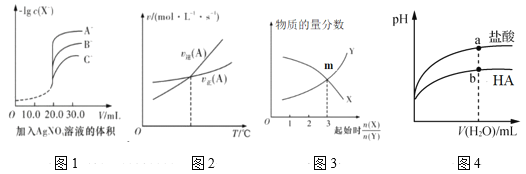
题目内容
【题目】根据下表回答下列问题。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
4 | ⑩ |
(1)写出下列元素符号:①______,⑥______,⑦______,⑨______。
(2)在这些元素中,最活泼的金属元素是______(填元素符号,下同),最活泼的非金属元素是______,最不活泼的元素是______。
(3)在这些元素的最高价氧化物对应的水化物中,酸性最强的是__________________,碱性最强的是__________________,呈两性的氢氧化物是__________________;三者之间相互反应的化学方程式是____________________________________。
(4)在这些元素(稀有气体元素除外)中,原子半径最小的是__________,原子半径最大的是____。
(5)在③与④中,化学性质较活泼的是__________,怎样用化学实验证明?______________ 在⑧与中,化学性质较活泼的是______,怎样用化学实验证明?________________________。
【答案】![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() 钠与冷水剧烈反应,放出氢气;
钠与冷水剧烈反应,放出氢气;![]() 与冷水反应缓慢
与冷水反应缓慢 ![]() 将氯气通入溴化钠溶液后溶液呈棕红色
将氯气通入溴化钠溶液后溶液呈棕红色
【解析】
(1)由元素在周期表中位置,可知①为N、②为F、③为Na、④为Mg、⑤为Al、⑥为Si、⑦为S、⑧为Cl、⑨为Ar、⑩为K、为Ca、为Br,
故答案为:N;Si;S;Ca;
(2)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱,故上述元素中,最活泼的金属元素是K,最活泼的非金属元素是F;稀有气体Ar的化学性质最不活泼,故答案为:K;F;Ar;
(3)所有元素的最高价氧化物对应水化物中,酸性最强的是高氯酸,其化学式为HClO4,上述元素中K的金属性最强,故KOH的碱性最强;Al(OH)3能与酸、碱反应生成相应的盐与水,属于两性氢氧化物,三者之间发生的反应方程式为:KOH+HClO4=KClO4+H2O、KOH+Al(OH)3=KAlO2+2H2O、3HClO4+Al(OH)3=Al(ClO4)3+3H2O,故答案为:HClO4;KOH;Al(OH)3;KOH+HClO4=KClO4+H2O、KOH+Al(OH)3=KAlO2+2H2O、3HClO4+Al(OH)3=Al(ClO4)3+3H2O;
(4)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故F原子半径最小,K原子半径最大,故答案为:F;K;
(5)③和④分别是Na和Mg,根据同主族元素金属性的递变规律可知,金属性Na>Mg,根据判断金属性强弱的方法,可依据二者单质分别与水反应的剧烈程度来判断其金属性强弱; ⑧和

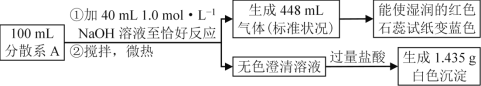
【题目】四种短周期元素X、Y、Z、W,原子序数依次增大,请结合表中信息回答下列问题。
字母代号 | X | Y | Z | W |
结构或性质 | X的最高价氧化物对应的水化物与其气态氢化物反应可得到一种盐 | 焰色反应呈黄色 | 在同周期主族元素形成的简单离子中,Z的离子半径最小 | 原子核外最外层电子数是次外层电子数的一半 |
(1)W在元素周期表中的位置为_________。
(2)四种元素的最高价氧化物对应的水化物中,有一种物质与其他三种物质在一定条件下均能发生化学反应,该元素是_____(填元素名称)。
(3)X元素的最高价氧化物对应的水化物与其气态氢化物反应得到的化合物为____(填化学式)。
(4)向含有Z元素的简单阳离子的溶液中加入过量的NaOH溶液,发生反应的离子方程式为______________。
(5)下列可用来判断Z和Mg的金属性强弱的方法是_____(填序号)。
a.测量两种元素单质的硬度和熔、沸点
b.比较单质与同浓度盐酸反应的剧烈程度
c.比较两种元素在化合物中化合价的高低