��Ŀ����
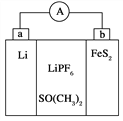
����Ŀ����֪��ӦCu(s)��2Ag��(aq)===Cu2��(aq)��2Ag(s)Ϊ�Է����е�������ԭ��Ӧ��������Ƴ�����ͼ��ʾ��ԭ��أ�����˵������ȷ����( )

A. ͭ�缫����������缫��ӦΪCu��2e��===Cu2��
B. ��ͭ�缫��������0.64 gʱ���������Һ����0.02 mol����ͨ��
C. װ�������п�װ�к���֬��KCl������Һ
D. ���缫�Ϸ�����ԭ��Ӧ���缫��������
���𰸡�D
��������A��ͭΪ��������Ϊ�����������ĵ缫��ӦΪCu-2e-=Cu2+����A����B����ͭ�缫��������0.64gʱ������ͭ�����ʵ���Ϊ0.01mol�����·��0.02mol����ͨ�����ڵ�·�����ӵĶ����ƶ�����B����C�������в���װ�к���֬��KCl������Һ������Ag+Ҫ��Cl-����AgCl��������D����D����Ϊ����������ԭ��Ӧ�������ӵõ������ɵ����������缫�������ӣ���D��ȷ����ѡD��

��ϰ��ϵ�д�
�����Ŀ