题目内容
13.对下列事故预防或处理方法正确的是( )| A. | 稀释浓硫酸时,为防止液体飞溅,将浓硫酸沿烧杯壁缓缓加入水中,并不断搅拌 | |
| B. | 欲配置500 mL l mol/LNaOH溶液,应将20gNaOH固体溶于500 mL水中 | |
| C. | 浓NaOH溶液溅到皮肤上,立即用水冲洗,然后涂上稀硫酸 | |
| D. | 钠着火时用二氧化碳灭火 |
分析 A.稀释浓硫酸时,沿烧杯内壁将浓硫酸缓缓加入水中,边加边搅拌;
B.应将20gNaOH固体溶于500mL水中,所得溶液体积不是500mL;
C.稀硫酸有腐蚀性;
D.钠能与二氧化碳反应生成碳酸钠和碳.
解答 解:A.稀释浓硫酸时,沿烧杯内壁将浓硫酸缓缓加入水中,边加边搅拌,注意安全,故A正确;
B.20g氢氧化钠的物质的量为0.5mol,但是氢氧化钠固体溶于500mL水中所得溶液体积不是500mL,溶液浓度不是1mol/L,故B错误;
C.浓NaOH溶液溅到皮肤上,立即用水冲洗,然后涂上稀硼酸溶液,故C错误;
D.金属钠在二氧化碳中能燃烧,不能用二氧化碳灭火器灭火,故D错误.
故选A.
点评 本题考查学生化学实验中的安全及事故处理知识,题目难度不大,旨在考查学生的基础知识的掌握,化学实验是化学的基础,要了解常见的实验操作,能对错误操作的后果做出判断,养成良好的实验习惯.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.环境问题正引起全社会关注,CO、CO2的应用对构建生态文明有重要意义
(Ⅰ)工业生产中已知3H2(g)+CO2(g)?CH3OH(g)+H2O (g)△H=-49.5KJ/mol
H2(g)+CO2(g)?CO(g)+H2O (g)△H=+41.3KJ/mol
(1)写出由H2 和CO 制 CH3OH 的热化学方程式CO(g)+2H2(g)=CH3OH(g)△H=-90.8KJ/mol
(2)H2 和CO 能自发反应生成CH3OH的条件是低温
(3)某温度下(1)中的平衡常数为1.2,能使平衡常数变为2的下列条件有D
A.增大压强 B.增大CO的浓度 C.升高温度 D.降低温度 E.使用催化剂
(4)在一定温度下密闭容器中,按H2与CO2体积比3:1进行投料,3H2+CO2?CH3OH+H2O 反应达到平衡的标志有BC
A.平衡常数不变 B.CO2的转化率不变
C.混和气体的平均相对分子质量不再改变 D.混合气体的密度不变
(Ⅱ) 将不同物质的量的H2O(g)和 CO分别通入体积为2L的恒容密闭容器中,发生反应:H2O(g)+CO(g)fCO2(g)+H2(g)△H,得到如下数据:
(1)650℃时,若在此容器中开始充入2molH2O(g)、lmolCO、1molCO2和2molH2,则反应在开始时正向进行(填“正向”或“逆向”).
(2)达平衡时实验Ⅱ和实验Ⅲ中H2O(g)的转化率的大小关系为:a2(HO)>a3(H2O)(填“>”、“<”或“=”).
(Ⅲ) 一定条件下反应:6H2(g)+2CO2(g)?C2H5OH (g)+3H2O(g)△H它的有关数据如图1所示.
(1)下列说法正确的是C
A.曲线Ⅰ对应的反应物起始物质的量为1.5 B.达平衡时,v(H2)正=v(CO2)逆
C.a点对应的H2的平衡转化率为90% D.b点对应的平衡常数K值大于c点
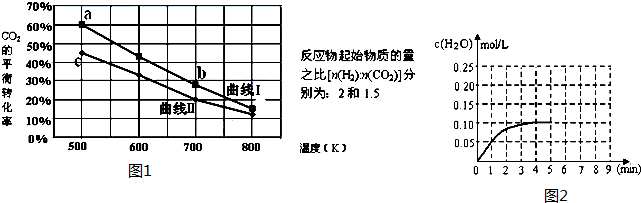
(2)温度为T1时CO(g)+H2O(g)?H2(g)+CO2(g),在体积为2升的密闭 容器中加入0.4molCO2和0.4mol H2,第4分钟达到平衡,反应中H2O的浓度变化情况如图所示,在第5分钟时向体系中再充入0.2molCO2和0.2mol H2,(其它条件不变),第8分钟达平衡,请在图2中画出5到9分钟的H2O的浓度变化曲线.
(Ⅰ)工业生产中已知3H2(g)+CO2(g)?CH3OH(g)+H2O (g)△H=-49.5KJ/mol
H2(g)+CO2(g)?CO(g)+H2O (g)△H=+41.3KJ/mol
(1)写出由H2 和CO 制 CH3OH 的热化学方程式CO(g)+2H2(g)=CH3OH(g)△H=-90.8KJ/mol
(2)H2 和CO 能自发反应生成CH3OH的条件是低温
(3)某温度下(1)中的平衡常数为1.2,能使平衡常数变为2的下列条件有D
A.增大压强 B.增大CO的浓度 C.升高温度 D.降低温度 E.使用催化剂
(4)在一定温度下密闭容器中,按H2与CO2体积比3:1进行投料,3H2+CO2?CH3OH+H2O 反应达到平衡的标志有BC
A.平衡常数不变 B.CO2的转化率不变
C.混和气体的平均相对分子质量不再改变 D.混合气体的密度不变
(Ⅱ) 将不同物质的量的H2O(g)和 CO分别通入体积为2L的恒容密闭容器中,发生反应:H2O(g)+CO(g)fCO2(g)+H2(g)△H,得到如下数据:
| 实验 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | CO | H2 | |||
| I | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
| II | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
| III | 900 | 2 | 1 | a | b | t |
(2)达平衡时实验Ⅱ和实验Ⅲ中H2O(g)的转化率的大小关系为:a2(HO)>a3(H2O)(填“>”、“<”或“=”).
(Ⅲ) 一定条件下反应:6H2(g)+2CO2(g)?C2H5OH (g)+3H2O(g)△H它的有关数据如图1所示.
(1)下列说法正确的是C
A.曲线Ⅰ对应的反应物起始物质的量为1.5 B.达平衡时,v(H2)正=v(CO2)逆
C.a点对应的H2的平衡转化率为90% D.b点对应的平衡常数K值大于c点

(2)温度为T1时CO(g)+H2O(g)?H2(g)+CO2(g),在体积为2升的密闭 容器中加入0.4molCO2和0.4mol H2,第4分钟达到平衡,反应中H2O的浓度变化情况如图所示,在第5分钟时向体系中再充入0.2molCO2和0.2mol H2,(其它条件不变),第8分钟达平衡,请在图2中画出5到9分钟的H2O的浓度变化曲线.
4.化学在生产和日常生活中有着重要的应用,下列说法不正确的是( )
| A. | FeCl3溶液可用于刻制印刷铜电路板 | |
| B. | Na2O2常用于潜水艇或呼吸面具的供氧剂 | |
| C. | 明矾溶于水形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 | |
| D. | 二氧化硅可做半导体材料 |
1.实验室配制1mol/L NaOH溶液,下列操作正确的是( )
| A. | 将NaOH固体放入容量瓶中溶解 | |
| B. | 溶解NaOH后,待溶液冷却至室温后转移到容量瓶中 | |
| C. | 定容后,将容量瓶倒置摇匀,发现液面降低,继续加水至刻度线 | |
| D. | 定容时俯视液面,所得溶液浓度偏低 |
8.下列化学变化属于加成反应的是( )
| A. | 在浓硫酸的作用下,乙醇和乙酸共热的反应 | |
| B. | 乙烯通入溴的四氯化碳溶液中的反应 | |
| C. | 在光照条件下甲烷与氯气的反应 | |
| D. | 在浓硫酸的作用下,苯在55℃左右与浓硝酸的反应 |
18.一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3=2HNO3+4N2↑+9H2O,在反应中发生还原反应与发生氧化反应的氮原子数之比为( )
| A. | 5:3 | B. | 5:4 | C. | 1:1 | D. | 3:5 |
5. 冰晶石(化学式为Na3AlF6)的晶体结构单元如图所示(位于大立方体的定点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心),已知冰晶石熔融时电离方程式为:Na3AlF6=3Na++AlF${\;}_{6}^{2-}$,那么大立方体的体心处
冰晶石(化学式为Na3AlF6)的晶体结构单元如图所示(位于大立方体的定点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心),已知冰晶石熔融时电离方程式为:Na3AlF6=3Na++AlF${\;}_{6}^{2-}$,那么大立方体的体心处 所代表的微粒为( )
所代表的微粒为( )
 冰晶石(化学式为Na3AlF6)的晶体结构单元如图所示(位于大立方体的定点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心),已知冰晶石熔融时电离方程式为:Na3AlF6=3Na++AlF${\;}_{6}^{2-}$,那么大立方体的体心处
冰晶石(化学式为Na3AlF6)的晶体结构单元如图所示(位于大立方体的定点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心),已知冰晶石熔融时电离方程式为:Na3AlF6=3Na++AlF${\;}_{6}^{2-}$,那么大立方体的体心处 所代表的微粒为( )
所代表的微粒为( )| A. | Na+ | B. | Al3+ | C. | F- | D. | AlF${\;}_{6}^{2-}$ |
2.下列各组离子,一定能在指定环境中大量共存的是( )
| A. | 在含有大量I-离子的溶液中:Cl?、Fe3+、Al3+、Cu2+ | |
| B. | 加入Al能放出H2的溶液中:Mg2+、NH4+、Cl-、Na+、SO42- | |
| C. | 使pH试纸变深蓝的溶液中:CO32-、NO3-、Na+、S2-、Al3+、SO32- | |
| D. | 在由水电离出的c(H+)=10-12 mol•L-1的溶液中:Na+、Ba2+、Cl?、Br? |
3.当光束通过下列分散系时,不能产生丁达尔效应的是( )
| A. | 氢氧化铁胶体 | B. | 雾 | C. | 稀豆浆 | D. | 硫酸铜溶液 |