��Ŀ����
����Ŀ����ͼ��ʵ�������Ʊ��������֤�������ʵ�װ��ͼ 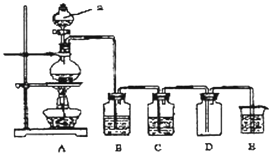
��1������װ��A����ȡ�����Ļ�ѧ����ʽ ��
��2��������ͼװ���Ʊ���������������֤�������ԣ�C12��Fe3+
��װ��B�е���Һ����������װ��D�мӵ�����Լ��ǣ�����ţ�����ѡ�Լ���a��ŨH2SO4 b��FeCl2��Һ c����ˮ�Ȼ��� d��KSCN��FeCl2�Ļ����Һ
��3����ͼ��ʾԲ����ƿ�ڼ���̼��a�м���Ũ���ᣬ��ʼʵ�飬���Ȳ��������建��ͨ������װ��ͬʱ�������ʵ�飺
ʵ��1��֤��SO2���������Ժ�Ư����
ʵ��2��֤��̼Ԫ�صķǽ����Աȹ�Ԫ�ص�ǿ
֤��SO2�������Ժ�Ư���ԣ�B��Ϊ����Na2S��Һ��C�м�Ʒ����Һ��D��Ӧ����������������Һ���ƣ���E�м�����Һ���ѧʽ����
��4��֤��̼Ԫ�صķǽ����Աȹ�Ԫ�ص�ǿ������Ϊ��ʵ��2���Ͻ�֮��Ӧ��θĽ�
��
���𰸡�
��1��MnO2+4HCl��Ũ�� ![]() MnCl2+Cl2��+2H2O
MnCl2+Cl2��+2H2O
��2����ȥ�����е��Ȼ��⣻d
��3�����Ը��������Һ��Na2SiO3
��4��D�и��������Һ����ɫ��E����Һ����ǣ����ձ�����ϴ��ƿ���Ҷ�����ʢ�м�ʯ�ҵĸ���
���������⣺��1��A�м��ȶ���������Ũ���ᷴӦ�����Ȼ��̡�������ˮ����ѧ����ʽ��MnO2+4HCl��Ũ�� ![]() MnCl2+Cl2��+2H2O��
MnCl2+Cl2��+2H2O��
���Դ��ǣ�MnO2+4HCl��Ũ�� ![]() MnCl2+Cl2��+2H2O����2��Ũ�����ӷ����Ʊ��������к����Ȼ������ʣ��Ȼ���������ˮ�������ڱ���ʳ��ˮ���ܽ�Ȳ�������ʢ�б���ʳ�γ�ȥ�����е��Ȼ��⣻��ʵ��Ŀ��֮һΪ֤�������ԣ��������������������������������ӣ���������������ͨ����������أ�����ѡ��d��
MnCl2+Cl2��+2H2O����2��Ũ�����ӷ����Ʊ��������к����Ȼ������ʣ��Ȼ���������ˮ�������ڱ���ʳ��ˮ���ܽ�Ȳ�������ʢ�б���ʳ�γ�ȥ�����е��Ȼ��⣻��ʵ��Ŀ��֮һΪ֤�������ԣ��������������������������������ӣ���������������ͨ����������أ�����ѡ��d��
���Դ��ǣ���ȥ�����е��Ȼ��⣻d����3��Ԫ�صķǽ�����Խǿ������������Ӧ��ˮ��������Խǿ������̼�������ǿ�ڹ��ᣬ������̼��������Ʒ�Ӧ�Ƶù������������CO2�л��ж�������������Ҳ�����������Һ��Ӧ����Ҫ���Ը��������Һ��ȥ����ֹ���ż��������̼��
���Դ��ǣ����Ը��������Һ��Na2SiO3����4����D�и��������Һ����ɫ��˵���������������E����Һ����ǣ�˵�����ж�����̼���壻�����к��ж�����̼�����ܸ���ʵ�飬��Ӧ�ų������ж�����̼�ĸ��ţ����ձ�����ϴ��ƿ���Ҷ�����ʢ�м�ʯ�ҵĸ���ܿ��ų������ж�����̼�ĸ��ţ�
���Դ��ǣ�D�и��������Һ����ɫ��E����Һ����ǣ����ձ�����ϴ��ƿ���Ҷ�����ʢ�м�ʯ�ҵĸ��
�����㾫�����������⣬������Ҫ�˽������Ļ�ѧ����(�����Ļ�ѧ���ʣ��������Ӧ�����������ɸ�̬���ǽ�����Ӧ����ˮ��Ӧ����Ӧ���뻹ԭ�����ʷ�Ӧ)����Ҫ����������ʵ�����Ʒ�(ʵ�����Ʒ���MnO2+4HCl��Ũ��=MnCl2+Cl2��+2H2O)�����֪ʶ���Ǵ���Ĺؼ���



