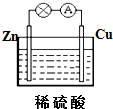
题目内容
1.下列说法正确的是( )| A. | 直径介于1 nm~100 nm之间的微粒称为胶体 | |
| B. | 制备Fe(OH)3胶体的方法是将饱和FeCl3溶液加热煮沸 | |
| C. | 利用丁达尔效应可以区分溶液和胶体 | |
| D. | 溶液、胶体与浊液的本质区别是其稳定性,胶体属于介稳体系 |
分析 A.从胶体是由分散质和分散剂组成的分析;
B.从实验室制备胶体 的方法和步骤分析判断;
C.胶体具有丁达尔效应;
D.分散质粒子的大小不同是分散系的本质区别.
解答 解:A.直径介于1nm~100nm之间的微粒为胶体分散质,不是胶体,故A错误;
B.氢氧化铁胶体制备是把饱和氯化铁溶液滴入沸水中加热至红褐色,故B错误;
C.胶体具有丁达尔效应,而溶液没有,故利用丁达尔效应可以区分溶液和胶体,故C正确;
D.分散质粒子的大小不同是分散系的本质区别,分散质微粒直径,小于1nm的形成分散系为溶液,大于100nm为浊液,1-100nm的为胶体,故D错误;
故选C.
点评 本题考查了胶体微粒直径大小的分析判断,胶体性质的理解应用,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
4.在汽车加油站见到的油罐车上,所贴的危险化学品标志是( )
| A. |  腐蚀品 | B. |  爆炸品 | C. |  有毒气体 | D. |  易燃液体 |
5.下表是元素周期表的一部分,请回答有关问题:
(1)表中化学性质最不活泼的元素,其原子结构示意图为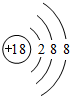 .
.
(2)表中能形成两性氢氧化物的元素是Al(用元素符号表示),写出该元素的单质与⑨最高价氧化物的水化物反应的化学方程式2Al+2OH-+2H2O═2AlO2-+3H2↑;
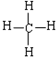
(3)④元素与⑦元素形成化合物的电子式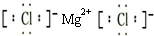 ;
;
(4)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是HClO4(填化学式).
(5)③元素与⑩元素两者核电荷数之差是26.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .
.(2)表中能形成两性氢氧化物的元素是Al(用元素符号表示),写出该元素的单质与⑨最高价氧化物的水化物反应的化学方程式2Al+2OH-+2H2O═2AlO2-+3H2↑;
(3)④元素与⑦元素形成化合物的电子式
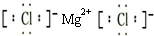 ;
;(4)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是HClO4(填化学式).
(5)③元素与⑩元素两者核电荷数之差是26.
16.下列物质既能与稀盐酸反应,又能与氢氧化钠溶液反应的是( )
| A. | Fe | B. | SiO2 | C. | Al(OH)3 | D. | CaCO3 |
6.下列烃没有同分异构体的是( )
| A. | 丙烷 | B. | 丁烷 | C. | 丁烯 | D. | 戊烷 |
13.下列物质的化学式可以表示真实的分子的是( )
| A. | K2S | B. | CO2 | C. | NaOH | D. | SiO2 |
10.对于处于化学平衡状态的反应CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,若要提高CO的转化率,下列措施中可行的是( )
| A. | 升温 | B. | 使用合适的催化剂 | ||
| C. | 增大压强 | D. | 增大H2O(g)的浓度 |

 .
.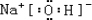 .
.