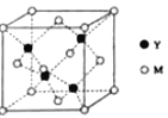
题目内容
【题目】向甲、乙两个恒容密闭容器中分别充入一定量的SiHCl3,发生反应:2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g) ΔH=+48kJ·mol1,维持容器的温度分别为T1℃和T2℃不变,反应过程中SiHCl3的转化率随时间的变化如图所示。下列说法正确的是( )
SiH2Cl2(g)+SiCl4(g) ΔH=+48kJ·mol1,维持容器的温度分别为T1℃和T2℃不变,反应过程中SiHCl3的转化率随时间的变化如图所示。下列说法正确的是( )
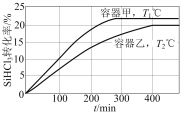
A.T1>T2
B.维持温度不变,向平衡后的乙容器中充入一定量的SiHCl3,平衡不移动
C.T2℃时,反应的平衡常数:K=![]()
D.T1℃时,向甲容器中起始充入0.2molSiHCl3和0.02molSiH2Cl2,SiHCl3的平衡转化率小于10%
【答案】AC
【解析】
A.升高温度,反应速率增大,达到平衡的时间缩短,故T1>T2,A项正确;
B.维持温度不变,向平衡后的乙容器中充入一定量的SiHCl3,平衡正向移动,B项错误;
C.由图可知,T2℃时SiHCl3的平衡转化率是20%,设容器体积为V,初始投SiHCl3xmol,Δn(SiHCl3)=0.2xmol,Δn(SiH2Cl2)=Δn(SiCl4)=0.1xmol,平衡时各物质的量:n(SiHCl3)=0.8xmol,n(SiH2Cl2)=n(SiCl4)=0.1xmol,则K=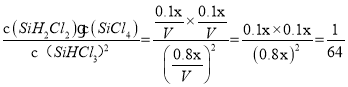 ,C项正确;
,C项正确;
D. 若T2℃时,向乙容器中起始充入0.2molSiHCl3和0.02molSiH2Cl2,当转化率为10%,此时Q<K,反应继续正向移动,达到平衡时转化率高于10%,若相同投量放在甲容器中,由于T1较大,转化率会大于乙装置,大于10%,D项错误;
答案选AC。

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案【题目】如图,利用培养皿探究SO2的性质。实验时向Na2SO3固体上滴几滴浓硫酸,立即用另一表面皿扣在上面。
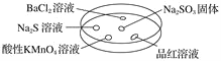
下表中对实验现象的描述或所做的解释不正确的是( )
选项 | 实验现象 | 解释 |
A | BaCl2溶液变浑浊 | SO2与BaCl2溶液反应产生了BaSO3沉淀 |
B | Na2S溶液变浑浊 | SO2与Na2S溶液反应产生了S单质 |
C | 酸性KMnO4溶液褪色 | SO2具有还原性 |
D | 品红溶液褪色 | SO2具有漂白性 |
A. A B. B C. C D. D