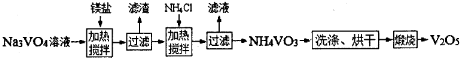
题目内容
随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金维生素”。已知钒的原子序数为23,回答下列问题:
(1)钒被认为是一种稀土元素,广泛分散于各种矿物中。钾钒铀矿中的钒原子最外层已达8电子稳定结构,其化学式为K2H6U2V2O15,若用氧化物的形式表示,该化合物的化学式为________。
(2)测定钒含量的方法是先把钒转化成V2O5,V2O5在酸性溶液里转变成VO2+,再用盐酸、硫酸亚铁、草酸等测定钒。总反应式可表示为:
VO2++H2C2O4→VO++CO2+H2O(未配平)
其中还原剂是________。若消耗0.9 g草酸,所对应钒元素质量是________g。
⑴K2O·2UO3·V2O5·3H2O。 ⑵H2C2O4 0.51。
(1)要用氧化物形式表示该化合物的化学式,必须先确定钒、铀的化合价。由于钾元素必定显+1价,根据“钒原子最外层已达8电子稳定结构”,可推出钒应失去5个电子变成氩原子结构,所以钒元素显+5价。再根据化合价规律可计算出铀的化合价应是+6。
(2)将题给反应式配平可得:VO2++H2C2O4= VO++2CO2↑+H2O。根据配平后的方程式计算可得到钒元素的质量数值。
(1)要用氧化物形式表示该化合物的化学式,必须先确定钒、铀的化合价。由于钾元素必定显+1价,根据“钒原子最外层已达8电子稳定结构”,可推出钒应失去5个电子变成氩原子结构,所以钒元素显+5价。再根据化合价规律可计算出铀的化合价应是+6。
(2)将题给反应式配平可得:VO2++H2C2O4= VO++2CO2↑+H2O。根据配平后的方程式计算可得到钒元素的质量数值。

练习册系列答案
相关题目
随着材料科学的发展,金属钒被誉为“合金的维生素”.为回收利用含钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺.
己知:V可形成VO2+、VO2+、VO3-等多种离子;部分含钒物质在水中的溶解性如下表所示:
该工艺的主要流程如下:
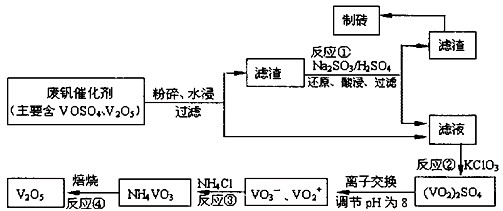
请回答下列问题
(1)工业上常用铝热反应法由V2O5冶炼金属钒,请写出反应的化学方程式 .
(2)反应①的离子方程式是 .
(3)在反应②中,每生成1mol(VO2)2SO4转移电子的数目为 .
(4)在离子交换过程中,发生可逆反应VO2++2OH-?VO3-+H2O.
该反应的化学平衡常数K 的表达式为 .
(5)反应③充分反应后,分离出NH4VO3的实验所需主要玻璃仪器为 ,为保证产品纯度,还应进行的操作名称是 .
己知:V可形成VO2+、VO2+、VO3-等多种离子;部分含钒物质在水中的溶解性如下表所示:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |

请回答下列问题
(1)工业上常用铝热反应法由V2O5冶炼金属钒,请写出反应的化学方程式
(2)反应①的离子方程式是
(3)在反应②中,每生成1mol(VO2)2SO4转移电子的数目为
(4)在离子交换过程中,发生可逆反应VO2++2OH-?VO3-+H2O.
该反应的化学平衡常数K 的表达式为
(5)反应③充分反应后,分离出NH4VO3的实验所需主要玻璃仪器为

 其中a、c二步的化学方程式可表示为
其中a、c二步的化学方程式可表示为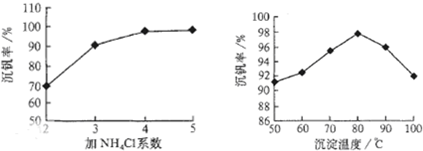
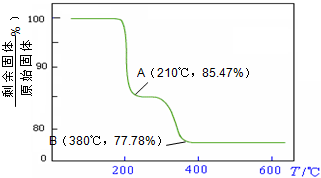 则NH4VO3在分解过程中
则NH4VO3在分解过程中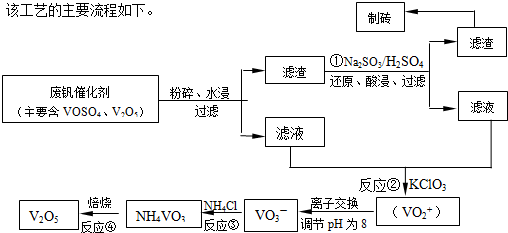
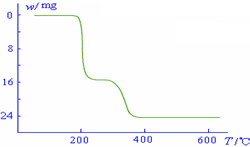 化的曲线如右图所示.则NH4VO3在分解过程中
化的曲线如右图所示.则NH4VO3在分解过程中