题目内容
(1)已知:N2(g)+O2(g)4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g);ΔH=-905 kJ·mol-1
4NO(g)+6H2O(g);ΔH=-905 kJ·mol-1
2H2(g)+O2(g)![]() 2H2O;ΔH=-483.6 kJ·mol-1
2H2O;ΔH=-483.6 kJ·mol-1
则N2(g)+3H2(g)![]() 2NH3(g)的ΔH=________。
2NH3(g)的ΔH=________。
(2)工业上在一定温度下,将一定量的N2和H2通入到体积为
①增大压强②增大反应物的浓度③使用催化剂④降低温度
(3)当化学反应N2(g)+2H2(g) ![]() 2NH3(g)达到平衡后改变某些条件(不改变N2、H2和NH3的用量),反应速率与反应时间的关系如下图,其中表示平衡混合物中NH3的含量最高的一段时间是___________________。当温度为T ℃时,将
2NH3(g)达到平衡后改变某些条件(不改变N2、H2和NH3的用量),反应速率与反应时间的关系如下图,其中表示平衡混合物中NH3的含量最高的一段时间是___________________。当温度为T ℃时,将

(4)合成氨的原料氢气是一种新型的绿色能源,具有广阔的发展前景。现用氢氧燃料电池进行下图所示实验:

①请写出氢氧燃料电池中的电极反应式:
负极:____________________________________________________________;
正极:____________________________________________________________。
②上图装置中,某一铜电极的质量减轻了
(1)-92.4 kJ·mol-1
(2)①②
(3)t0—t1 ![]() (mol·L-1) -2
(mol·L-1) -2
(4)①负极:2H2+4OH--4e-![]() 4H2O正极:O2+2H2O+4e-
4H2O正极:O2+2H2O+4e-![]() 4OH-
4OH-
②0.56
解析:(1)①-②×![]() +3×
+3×![]() 得
得
N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1
2NH3(g) ΔH=-92.4 kJ·mol-1
(2)催化剂不能改变平衡,平衡常数随温度变化而变化,因此只有①②符合。
(3)NH3含最高一段为t0-t1,K=![]() (mol·L-1)-2
(mol·L-1)-2
(4)①负极:2H2+4OH--4e-![]() 4H2O
4H2O
正极:O2+2H2O+4e-![]() 4OH-
4OH-![]()
②n(Cu)=![]() =0.05 mol
=0.05 mol
n(e-)=0.1 mol
n(O2)=0.025 mol V(O2)=

 教材全解字词句篇系列答案
教材全解字词句篇系列答案 N2(g)+2CO2(g)
N2(g)+2CO2(g) N2(g) +2CO2(g)的△H=___________。
N2(g) +2CO2(g)的△H=___________。

 )
) 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol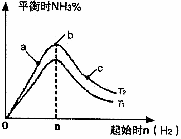


 2NO(g) ΔH
2NO(g) ΔH ,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH__________
,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH__________ (填“大于”、“小于”或“等于”)。
(填“大于”、“小于”或“等于”)。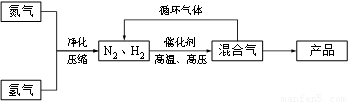
 2NO(g) ΔH
2NO(g) ΔH ,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH__________
,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH__________ (填“大于”、“小于”或“等于”)。
(填“大于”、“小于”或“等于”)。