题目内容
(14分)工业上合成氨是在一定条件下进行如下反应:N2(g) + 3H2(g) ≒ 2NH3(g),其部分工艺流程如下:
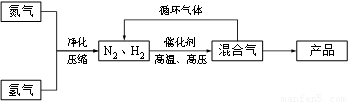
回答下列问题:
(1) 已知: N2(g)
+ O2(g)  2NO(g) ΔH
2NO(g) ΔH +180.5kJ/mol
+180.5kJ/mol
4NH3(g)
+ 5O2(g)  4NO(g) + 6H2O(g) ΔH
4NO(g) + 6H2O(g) ΔH −905kJ/mol
−905kJ/mol
2H2(g)
+ O2(g)  2H2O(g) ΔH
2H2O(g) ΔH −483.6kJ/mol
−483.6kJ/mol
则N2(g)
+ 3H2(g) ≒ 2NH3(g) ΔH  ________________。
________________。
(2) 如果工业上,在一定温度下,将1.5 mol N2气体和6 mol H2气体通入到体积为1升的密闭容器中。当反应达到平衡时,容器内气体的压强为起始时的80%,则其平衡常数为_______。改变下列条件,能使平衡向正反应方向进行且平衡常数不变的是__________。
①增大压强 ②增大反应物的浓度 ③使用催化剂 ④降低温度
(3) 合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程。即反应后通过降低混合气体的温度而使氨气分离出来。这种分离物质的方法其原理类似于下列方法中的________(填编号),其理由是__________。
①过滤 ②蒸馏 ③渗析 ④萃取
(4) 可以用氯气来检验输送氨气的管道是否漏气,如果漏气则会有白烟(成分为氯化铵)生成,该反应的化学方程式为__________。
(5) 假如该厂生产氨水的物质的量浓度为20 mol/L,实验室若需用80 mL浓度为5 mol/L的氨水时,需取20 mol/L的氨水__________mL(用100 mL的容量瓶)。假如该氨水的 ,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH__________
,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH__________ (填“大于”、“小于”或“等于”)。
(填“大于”、“小于”或“等于”)。
(1) −92.4 kJ/mol 2分 (2) 0.057 (mol·L−1)−2(可不写单位)2分 ①② 2分
(3) ② 两者都是通过改变物质的状态来进行混合物的分离 2分
(4) 8NH3 + 3Cl2 → 6NH4Cl + N2 2分 (5) 25 2分 < 2分
【解析】(1)考查盖斯定律的应用。根据已知反应可知(①×2-②+③×3)÷2即得到N2(g) + 3H2(g)
 2NH3(g),所以△H=(180.5kJ/mol×2+905kJ/mol-483.6kJ/mol×3)÷2=−92.4 kJ/mol。
2NH3(g),所以△H=(180.5kJ/mol×2+905kJ/mol-483.6kJ/mol×3)÷2=−92.4 kJ/mol。
(2)
N2(g) + 3H2(g)  2NH3(g)
2NH3(g)
起始量(mol) 1.5 6 0
转化量(mol) x 3x 2x
平衡量(mol) 1.5-x 6-3x 2x
所以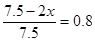
解得x=0.75mol
所以平衡常数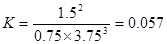 。
。
平衡常数只与温度有关系,所以选项④不正确。催化剂不能影响平衡状态,③不正确。正反应是体积减小的,增大压强平衡向正反应方向移动,增大反应物的浓度平衡也向正反应方向移动,所以答案选①②
(3)氨气易液化,即可以实现气液分离,所以分离方法类似于蒸馏。
(4)氯气极易强氧化性,能把氨气液化生成氮气,而氯气被还原生成氯化氢,氯化氢和氨气反应冒白烟,方程式为8NH3 + 3Cl2 → 6NH4Cl + N2 。
(5)稀释过程中溶质是不变的,所以需取20 mol/L的氨水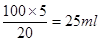 。如果盐酸的pH=14-a。则氨水过量,溶液显碱性。因此要使反应后溶液显中性,则盐酸的pH必须小于14-a。
。如果盐酸的pH=14-a。则氨水过量,溶液显碱性。因此要使反应后溶液显中性,则盐酸的pH必须小于14-a。

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案


 2NH3(g)回答下列问题:
2NH3(g)回答下列问题: )+c(
)+c( )+c(H2SO3)]=c(
)+c(H2SO3)]=c( )+c(NH3·H2O)
)+c(NH3·H2O)