题目内容
5.将Na2CO310.6g跟 500mL 0.8mol/L的盐酸充分反应.然后将溶液加水稀释至1L,求:(l)生成二氧化碳的体积(标准状况);
(2)稀释后溶液中H+的物质的量浓度;
(3)稀释后溶液中Cl-的物质的量浓度.
分析 n(Na2CO3)=$\frac{10.6g}{106g/mol}$=0.1mol,n(HCl)=0.8mol/L×0.5L=0.4mol,根据Na2CO3+2HCl=2NaCl+H2O+CO2↑知,如果0.1mol碳酸钠完全反应生成二氧化碳,需要0.2molHCl<0.4mol,则稀盐酸过量.
(1)根据C原子守恒计算生成二氧化碳体积;
(2)溶液稀释前后氢离子物质的量不变,根据c=$\frac{n}{V}$计算稀释后氢离子浓度;
(3)溶液稀释前后氯离子物质的量不变,据c=$\frac{n}{V}$计算稀释后Cl-的物质的量浓度.
解答 解:n(Na2CO3)=$\frac{10.6g}{106g/mol}$=0.1mol,n(HCl)=0.8mol/L×0.5L=0.4mol,根据Na2CO3+2HCl=2NaCl+H2O+CO2↑知,如果0.1mol碳酸钠完全反应生成二氧化碳,需要0.2molHCl<0.4mol,则稀盐酸过量;
(1)根据C原子守恒得生成V(CO2)=n(CO2)Vm=n(Na2CO3)Vm=0.1mol×22.4L/mol=2.24L,
答:生成二氧化碳的体积(标准状况)为2.24L;
(2)根据方程式中Na2CO3---2HCl知,0.1mol碳酸钠完全反应需要0.2molHCl,则剩余n(H+)=0.4mol-0.2mol=0.2mol,溶液稀释前后氢离子物质的量不变,稀释后c(H+)=$\frac{n}{V}$=$\frac{0.2mol}{1L}$=0.2mol/L,
答:稀释后氢离子浓度为0.2mol/L;
(3)反应过程中氯离子不参加反应,且溶液稀释前后氯离子物质的量不变,根据Cl原子守恒得n(Cl-)=n(HCl)=0.4mol,稀释后溶液中c(Cl-)=$\frac{n}{V}$=$\frac{0.4mol}{1L}$=0.4mol/L,
答:稀释后氯离子浓度为0.4mol/L.
点评 本题考查化学方程式有关计算,为高频考点,侧重考查学生分析计算能力,当反应物的物质的量都已知时要进行过量计算,为易错点.

 阅读快车系列答案
阅读快车系列答案| A. | 溶液的pH变大 | |
| B. | c(Na+)与c(SO42-)的比值不变 | |
| C. | 电解过程中,向阳极附近溶液滴入酚酞,溶液变为红色 | |
| D. | 阴、阳极产生气体在相同条件下体积之比为1:2 |
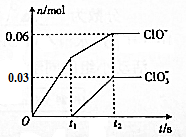 将-定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),ClO-和ClO${\;}_{3}^{-}$的物质的量(n)与反应时间(t)的变化关系如图所示,则t2时刻,n(还原产物):n(氧化产物)为( )
将-定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),ClO-和ClO${\;}_{3}^{-}$的物质的量(n)与反应时间(t)的变化关系如图所示,则t2时刻,n(还原产物):n(氧化产物)为( )| A. | 3:7 | B. | 7:3 | C. | 3:2 | D. | 2:3 |
 正丁醛是一种化工原料.某实验小组利用如图装置合成正丁醛.发生的反应如下:
正丁醛是一种化工原料.某实验小组利用如图装置合成正丁醛.发生的反应如下:CH3CH2CH2CH2OH $→_{H_{2}SO_{4}加热}^{Na_{2}Cr_{2}O_{7}}$CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
| 沸点/0C | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中.在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸汽出现时,开始滴加B中溶液.滴加过程中保持反应温度为90-95℃,在E中收集90℃以下的馏分.将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75-77℃馏分,产量2.0g.
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由不能,浓硫酸溶于水放出大量热,容易发生迸溅伤人.
(2)加入沸石的作用是防止暴沸
(3)上述装置图中,B仪器的名称是分液漏斗,D仪器的名称是直形冷凝管.
(4)分液漏斗使用前必须进行的操作是c(填正确答案标号).
a.润湿 b.干燥 c.检漏 d.标定
(5)将正丁醛粗产品置于分液漏斗中分水时,水在下层(填“上”或“下”)
(6)反应温度应保持在90-95℃,其原因是:保证正丁醛及时蒸出,促使反应正向进行,又可尽量避免其被进一步氧化
(7)本实验中,正丁醛的产率为51%
(8)已知正丁醛在碱性条件下可以被新制氢氧化铜氧化,写出该反应的化学方程式:CH3CH2CH2CHO+NaOH+2Cu(OH)2$\stackrel{△}{→}$CH3CH2CH2COONa+Cu2O↓+3H2O.
| A. | ①中水的电离程度最小,③中水的电离程度最大 | |
| B. | 将②、③混合,若pH=7,则消耗溶液的体积②=③ | |
| C. | 将四份溶液稀释相同的倍数后,溶液的pH:③>④>②>① | |
| D. | 将①、④混合,若有c(CH3COO-)>c(H+),则混合溶液一定呈碱性 |

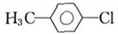 .
. +C2H5OH$?_{△}^{浓硫酸}$
+C2H5OH$?_{△}^{浓硫酸}$ +H2O.
+H2O.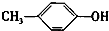 +CH2I→
+CH2I→ +HI.
+HI. 的同分异构体有多种,其中既含有酚羟基又含有酯基的同分异构体共有19种.
的同分异构体有多种,其中既含有酚羟基又含有酯基的同分异构体共有19种.