题目内容
【题目】碳、铜、锡及其化合物有许多用途。回答下列问题
(1)在元素周期表里,锡和碳同族,锡在第五周期。基态锡原子的价电子排布式为__________,据此推测,锡的常见正价是__________。
(2)磷化铜(Cu3P2)用于制造磷青铜,磷青铜是含少量锡、磷的铜合金。磷化铜与水反应产生有毒的磷化氢(PH3)气体,PH3分子的空间构型为__________;P、S的第一电离能(I1)的大小为I1(P) __________I1(S)(填“>”“<”或“=”)
(3)CO32-中C原子的杂化轨道类型为__________;乙烯分子中σ键与π键数目之比为__________。
(4)NH3的沸点__________(填“高于”或“低于”)PH3的沸点,原因是____________________。
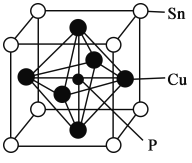
(5)磷青铜晶体的晶胞结构如图所示,该晶体中P原子位于由铜原子形成的__________的空隙中。若晶体密度为ag·cm-3,P与最近的Cu原子的核间距为__________nm(用含NA的代数式表示)。
【答案】5s25p2 +2、+4 三角锥形 > sp2 5:1 高于 NH3分子间能形成氢键,而PH3不能 正八面体 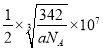
【解析】
(1)锡在第五周期ⅣA族元素,其价电子为最外层电子数,价电子排布式为5s25p2,第四主族常见价态为+2、+4价;
(2)N、P为同主族元素,和NH3的分子构型相同,NH3为三角锥型,则PH3为三角锥型;第一电离能在同周期中随原子序数的递增,有增大的趋势,但核外电子拍布满足充满或半充满状态时,第一电离能大于其后面的元素的第一电离能,故I1(P)>I1(S);
(3)CO32-中C原子孤对电子数=![]() (a-所带电荷-xb)=
(a-所带电荷-xb)=![]() (4+2-3×2)=0,杂化轨道类型为sp2;乙烯的结构简式:CH2=CH2,则σ键5条,π键1条,比值为:5:1;
(4+2-3×2)=0,杂化轨道类型为sp2;乙烯的结构简式:CH2=CH2,则σ键5条,π键1条,比值为:5:1;
(4)氢键为分子间的作用力,对物质的熔沸点影响较大,氢键存在于,氨分子间存在氢键,磷化氢无氢键,则氨的沸点高于磷化氢;
(5)观察磷青铜晶体的晶胞结构,Cu原子位于正方体的六个面的中心位置,形成正八面体的结构;P原子与最近的Cu原子之间的距离为:![]() 棱长,Sn原子:8×
棱长,Sn原子:8×![]() =1,Cu原子:6×
=1,Cu原子:6×![]() =3,P为1,化学式为:SnCu3P,摩尔质量为:342g/mol,1mol时的体积为:342g/ ag/cm3,由NA个晶胞组成,晶胞的体积为:342 cm3/aNA,棱长=
=3,P为1,化学式为:SnCu3P,摩尔质量为:342g/mol,1mol时的体积为:342g/ ag/cm3,由NA个晶胞组成,晶胞的体积为:342 cm3/aNA,棱长=![]() cm,P与最近的Cu原子的核间距为
cm,P与最近的Cu原子的核间距为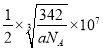 ;
;
(1)锡在第五周期ⅣA族元素,其价电子为最外层电子数,价电子排布式为5s25p2,第四主族常见价态为+2、+4价;
(2)N、P为同主族元素,和NH3的分子构型相同,NH3为三角锥型,则PH3为三角锥型;第一电离能在同周期中随原子序数的递增,有增大的趋势,但核外电子拍布满足充满或半充满状态时,第一电离能大于其后面的元素的第一电离能,故I1(P)>I1(S),答案为:三角锥型;>;
(3)CO32-中C原子孤对电子数=![]() (a-所带电荷-xb)=
(a-所带电荷-xb)=![]() (4+2-3×2)=0,杂化轨道类型为sp2;乙烯的结构简式:CH2=CH2,则σ键5条,π键1条,比值为:5:1;
(4+2-3×2)=0,杂化轨道类型为sp2;乙烯的结构简式:CH2=CH2,则σ键5条,π键1条,比值为:5:1;
(4)氢键为分子间的作用力,对物质的熔沸点影响较大,氢键存在于,氨分子间存在氢键,磷化氢无氢键,则氨的沸点高于磷化氢,答案为:高于;NH3分子间能形成氢键,而PH3不能;
(5)观察磷青铜晶体的晶胞结构,Cu原子位于正方体的六个面的中心位置,形成正八面体的结构;P原子与最近的Cu原子之间的距离为:![]() 棱长,Sn原子:8×
棱长,Sn原子:8×![]() =1,Cu原子:6×
=1,Cu原子:6×![]() =3,P为1,化学式为:SnCu3P,摩尔质量为:342g/mol,1mol时的体积为:342g/ ag/cm3,由NA个晶胞组成,晶胞的体积为:342 cm3/aNA,棱长=
=3,P为1,化学式为:SnCu3P,摩尔质量为:342g/mol,1mol时的体积为:342g/ ag/cm3,由NA个晶胞组成,晶胞的体积为:342 cm3/aNA,棱长=![]() cm,P与最近的Cu原子的核间距为
cm,P与最近的Cu原子的核间距为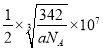 ;
;