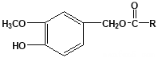
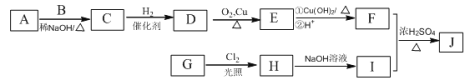
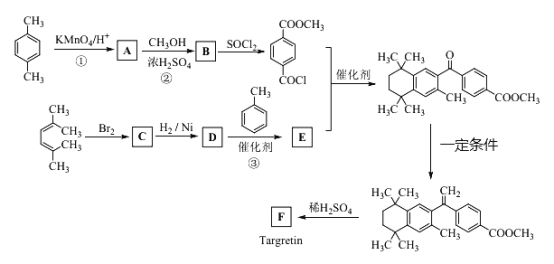
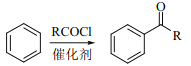
题目内容
【题目】I.下列两种溶液中,室温下由水电离生成的H+浓度之比(①∶②)是 。
①pH=1的盐酸 ②0.01 mol·L-1的NaOH溶液
II.已知水在25℃和95℃时,其电离平衡曲线如图所示:
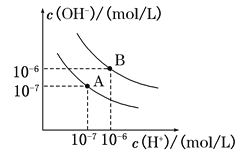
(1)则25℃时水的电离平衡曲线应为 (填“A”或“B”);95℃时水的离子积KW= 。
(2)25℃时,将pH=9的Ba(OH)2溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则Ba(OH)2溶液与H2SO4溶液的体积比为 。
(3)曲线A对应温度下,pH=2的盐酸溶液和pH=11的氢氧化钠溶液按体积比1:9混合,溶液的pH约为 。
【答案】I. 1:10 ;II.(1)A ;1×10-12(2)10:1(3)4
【解析】
试题分析:I.①酸溶液中水电离产生的氢离子浓度等于溶液中氢氧根浓度,室温下,pH=1的盐酸中氢氧根浓度为1×10-13mol/L,②碱溶液中的氢离子全部来自水的电离,室温下,0.01 mol·L-1的NaOH溶液中氢离子浓度为1×10-12mol/L,由水电离生成的H+浓度之比(①∶②)是1:10。
II.(1)曲线A条件下Kw=c(H+)c(OH-)=10-7×10-7=10-14,曲线B条件下Kw=c(H+)c(OH-)=10-6×10-6=10-12;水的电离时吸热过程,加热促进电离,所以A曲线代表25℃时水的电离平衡曲线;(2)B为95℃水的电离平衡曲线,Kw=c(H+)c(OH-)=10-6×10-6=10-12。
(2)25℃时,所得混合溶液的pH=7,溶液呈中性,酸碱恰好中和,n(OH-)=n(H+),则V[Ba(OH)2]×10-5 mol/L=V(H2SO4)×10-4 mol/L,则Ba(OH)2溶液与H2SO4溶液的体积比为10:1。
(3)pH=2盐酸c(H+)=0.01mol/L,pH=11的氢氧化钠溶液c(OH-)=0.001mol/L,则混合液中c(H+)=(0.01×1-0.001×9)/(1+9)=0.0001mol/L,pH=4。

 53随堂测系列答案
53随堂测系列答案【题目】某化学兴趣小组为了探究碳酸钙与稀盐酸反应过程中的速率变化,在VmL稀盐酸中加入足量的碳酸钙,收集反应放出的CO2(气体体积已换算为标准状况下的数值),实验记录如下(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
CO2体积(mL) | 50 | 120 | 232 | 290 | 310 |
(1)0~1 min、1~2 min、2~3 min、3~4 min、4~5 min五个时间段中,_________反应速率最快。
(2)假设溶液体积不变,4~5min时间段以盐酸的浓度变化来表示的该反应速率为____________________________。
(3)为了降低上述化学反应的反应速率,向溶液中加入下列物质,你认为可行的是
_______________(填编号)。
a.蒸馏水 b.浓盐酸 c.NaCl固体 d.NaCl溶液
(4)除了上述方法外,你认为还可以采取哪些措施来降低化学反应速率?(试写两条)_______________________________________________________________________,
________________________________________________________________________。
【题目】(平行班做)下表是有机物A、B的有关信息。
A | B |
①能使溴的四氯化碳溶液退色 ②比例模型为: ③能与水在一定条件下反应生成醇 | ①由C、H两种元素组成 ②球棍模型为: |
根据表中信息回答下列问题:
(1)写出A的电子式_____________________。
(2)写出在一定条件下,A生成高分子化合物的化学反应方程式________________________________。
(3)A与氢气发生加成反应后生成分子C,C在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2。当n=_____ 时,这类有机物开始出现同分异构体。
(4)B具有的性质有_____________________(填序号)。
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大
⑤与酸性KMnO4溶液和溴水反应使之退色 ⑥任何条件下不与氢气反应
(5)写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:_____________________________。