题目内容
17.在次氯酸溶液中,存在如下电离平衡:HClO?H++ClO-.(1)加入固体NaOH,电离平衡向正反应方向移动(填“正”或“逆”,下同),c(H+)减小;(填“增大”或“减小”或“不变”,下同)
(2)加入固体NaClO,电离平衡向逆反应方向移动,c(H+)减小;
(3)升高温度,电离平衡向正反应方向移动,c(H+)增大;
(4)NaClO水解属于吸热反应(填“吸热”或“放热”),写出NaClO水解的化学方程式NaClO+H2O?HClO+NaOH.
分析 (1)加入固体NaOH,消耗氢离子,促进电离;
(2)加入固体NaClO,次氯酸根离子浓度增大,抑制电离;
(3)因为电离为吸热过程,所以升高温度,电离平衡向正反应方向移动;
(4)NaClO水解属于吸热反应.
解答 解:(1)加入固体NaOH,消耗氢离子,电离平衡向正反应方向移动,则c(H+)减小,故答案为:正;减小;
(2)加入固体NaClO,次氯酸根离子浓度增大,所以电离平衡向逆反应方向移动,c(H+)减小,故答案为:逆;减小;
(3)因为电离为吸热过程,所以升高温度,电离平衡向正反应方向移动,c(H+)增大,故答案为:正;增大;
(4)NaClO水解属于吸热反应,所以NaClO水解的化学方程式为NaClO+H2O?HClO+NaOH,故答案为:吸热;NaClO+H2O?HClO+NaOH;
点评 本题考查电离平衡的移动,明确影响平衡移动的因素即可解答,注意利用加入固体NaOH促进电离及同离子效应来分析解答.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
7.下列离子组一定能够大量共存的是( )
| A. | CO32-Cl- Na+ H+ | B. | K+ Na+ SO42- Ba2+ | ||
| C. | Cl- Na+ Ag+ NO3- | D. | CO32- SO42- Cl- OH- |
8.下列化学式能表示一种纯净物的是( )
| A. | C4H10 | B. | C3H6 | C. | C2H6O | D. | CH2Br2 |
5.化学与生活、社会密切相关.下列说法正确的是( )
| A. | 臭氧能对水体消毒,是因为其能杀死水中的病菌 | |
| B. | 执行“限塑令”主要是为了节约资源 | |
| C. | 含磷洗涤剂因为其易被细菌分解,所以不会导致水体污染 | |
| D. | 新装修的住房中放置任何花卉都能降低居室中甲醛的含量 |
12.某一反应物的浓度是1.2mol/L,经过20s后,它的浓度变成了0.4mol/L,在这20s内它的化学反应速率为( )
| A. | 0.04 | B. | 0.04mol/(L.s) | C. | 0.08mol(L.s) | D. | 0.04mol/L |
9.下列物质在一定条件下能与甲烷发生取代反应的是( )
| A. | 氯气 | B. | 酸性高锰酸钾溶液 | ||
| C. | 氢氧化钠溶液 | D. | 溴的四氯化碳溶液 |
11.工业上常利用含硫废水生产Na2S2O3•5H2O,实验室可用如下装置(略去部分夹持仪器)模拟生产过程.

烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)═Na2SO3(aq)+H2S(aq) (Ⅰ)
2H2S(aq)+SO2(g)═3S(s)+2H2O(l) (Ⅱ)
S(s)+Na2SO3(aq)?Na2S2O3(aq) (Ⅲ)
已知:Na2S2O3•5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液.
(1)写出Na2S2O3溶液和稀盐酸反应的离子方程式S2O32-+2H+=SO2↑+S↓+H2O.
(2)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若一段时间后液注高度不变,则整个装置气密性良好,装置E的作用是吸收多余的气体,防止污染空气.
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择c.
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
实验中,已知反应(Ⅲ)相对较慢,则烧瓶C中反应达到终点的现象是淡黄色沉淀完全消失.
(4)反应终止后,烧瓶C中的溶液经蒸发浓缩、冷却结晶即可析出Na2S2O3•5H2O,其中可能含有Na2SO3、Na2SO4等杂质.为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整.
(5)Na2S2O3•5H2O的溶液度随温度升高显著增大,所得产品通过重结晶方法提纯.

烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)═Na2SO3(aq)+H2S(aq) (Ⅰ)
2H2S(aq)+SO2(g)═3S(s)+2H2O(l) (Ⅱ)
S(s)+Na2SO3(aq)?Na2S2O3(aq) (Ⅲ)
已知:Na2S2O3•5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液.
(1)写出Na2S2O3溶液和稀盐酸反应的离子方程式S2O32-+2H+=SO2↑+S↓+H2O.
(2)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若一段时间后液注高度不变,则整个装置气密性良好,装置E的作用是吸收多余的气体,防止污染空气.
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择c.
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
实验中,已知反应(Ⅲ)相对较慢,则烧瓶C中反应达到终点的现象是淡黄色沉淀完全消失.
(4)反应终止后,烧瓶C中的溶液经蒸发浓缩、冷却结晶即可析出Na2S2O3•5H2O,其中可能含有Na2SO3、Na2SO4等杂质.为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量产品加适量蒸馏水配成稀溶液,滴加足量BaCl2溶液. | |
| 步骤2: |
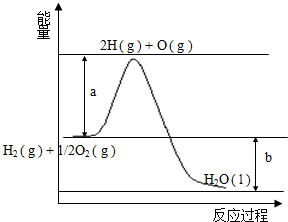 已知H2的燃烧热为285.8kJ•mol-1,反应过程中能量变化如图:请回答下列问题:
已知H2的燃烧热为285.8kJ•mol-1,反应过程中能量变化如图:请回答下列问题: