题目内容
【题目】如图是实验室制备1,2﹣二溴乙烷并进行一系列相关实验的装置(加热及夹持设备已略).有关数据列表如下:
乙醇 | 1,2﹣二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g/cm3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | ﹣130 | 9 | ﹣116 |

(1)A中药品为1:3的无水乙醇和浓硫酸混合液,使用连通滴液漏斗相比使用分液漏斗滴加液体的优点是;B中插长玻璃管的作用有: .
(2)写出C装置中的离子反应方程式;装置D中品红溶液的作用是 .
(3)反应过程中应用冷水冷却装置E,其主要目的是;但又不能过度冷却(如用冰水),其原因是 .
(4)学生发现反应结束时,无水乙醇消耗量大大超过理论值,其原因是 .
(5)装置F的作用是;写出F装置中发生反应的化学方程式 .
【答案】
(1)能使连通滴液漏斗里的溶液容易滴下;稳压作用,可检查装置是否发生堵塞
(2)SO2+2OH﹣=SO32﹣+H2O、CO2+2OH﹣=CO32﹣+H2O;验证二氧化硫是否被除尽
(3)减少液溴挥发;1,2﹣二溴乙烷易凝结成固体而发生堵塞
(4)乙醇挥发、副反应发生或反应太剧烈
(5)吸收挥发出的溴蒸汽,减少对环境的污染;Br2+2NaOH=NaBr+NaBrO+H2O
【解析】解:(1)连通滴液漏斗使上下容器中的压强相同,液体容易流下,所以气体发生装置使用连通滴液漏斗的原因使连通滴液漏斗里的溶液容易滴下;B中长导管起稳压作用,可检查装置是否发生堵塞,所以答案是:能使连通滴液漏斗里的溶液容易滴下;稳压作用,可检查装置是否发生堵塞;(2)用氢氧化钠溶液吸收SO2和CO2气体发生反应的离子方程式为SO2+2OH﹣=SO32﹣+H2O、CO2+2OH﹣=CO32﹣+H2O,无水乙醇和浓硫酸混合液制备乙烯时,会有副产物二氧化硫生成,而二氧化硫能使品红褪色,所以用品红溶液检验二氧化硫是否被氢氧化钠吸收完全,所以答案是:SO2+2OH﹣=SO32﹣+H2O、CO2+2OH﹣=CO32﹣+H2O;验证二氧化硫是否被除尽;(3)液溴易挥发,反应过程中应用冷水冷却装置E,能减少液溴挥发;由表中数据可知1,2﹣二溴乙烷的熔点为9℃,如用冰水冷却时温度太低,1,2﹣二溴乙烷会凝结为固体,从而导致导管堵塞,所以答案是:减少液溴挥发;1,2﹣二溴乙烷易凝结成固体而发生堵塞;(4)乙醇在浓硫酸作催化剂作用下会有乙醚等副产物生成,反应太剧烈时乙醇部分挥发;所以答案是:乙醇挥发、副反应发生或反应太剧烈;(5)用NaOH溶液吸收挥发出的溴蒸汽,减少对环境的污染,发生反应的化学方程式为Br2+2NaOH=NaBr+NaBrO+H2O,所以答案是:吸收挥发出的溴蒸汽,减少对环境的污染;Br2+2NaOH=NaBr+NaBrO+H2O.

 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
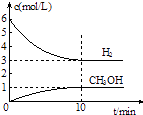
黄冈小状元同步计算天天练系列答案【题目】利用如图所示装置,采用适当试剂可完成下表的探究实验,并得出相应的实验结论,其中错误的是
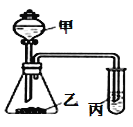
选项 | 甲 | 乙 | __丙 | 装置丙中的现象 | 实验结论 |
A | 稀硝酸 | 碳酸钾 | 澄淸石灰水 | 变浑浊 | 酸性:HNO3>H2CO3 |
B | 稀硫酸 | 碳酸钠 | 次氯酸钙溶液 | 白色沉淀 | 酸性:H2CO3>HClO |
C | 浓盐酸 | 大理石 | 硅酸钠溶液 | 白色沉淀 | 非金属性:C>Si |
D | 浓盐酸 | 高锰酸钾 | 石蕊溶液 | 先变红后褪色 | 氯水既有酸性,又具有漂白性 |
A. A B. B C. C D. D