题目内容
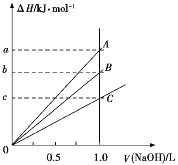
【题目】pH是溶液中c(H+)的负对数,若定义pC是溶液中微粒物质的量浓度的负对数,则常温下,某浓度的草酸(H2C2O4)水溶液中pC(H2C2O4),pC(HC2O4-)、pC(C2O42-)随着溶液pH的变化曲线如图所示:下列说法不正确的是

A. 曲线I代表HC2O4-的浓度随着pH增大先变小后变大
B. 草酸的电离常数 Kal=l×10-1.3; Ka2= l×10-4.3
C. pH=4时,c(HC2O4-)>c(C2O42-)>c(H2C2O4)
D. 
【答案】A
【解析】A、曲线I代表HC2O4-的浓度随着pH增大先变大后变小,PC越大,HC2O4-的浓度越小,故A错误;B、图中两点c(HC2O4-)=c(H2C2O4)=c(C2O42―),草酸的电离常数Kal=c(HC2O4-)c(H+ )/c(H2C2O4)=c(H+ )=l×10-1.3,同理Ka2=c(C2O42―)c(H+ )/c(HC2O4― )=c(H+ )= l×10-4.3,故B正确;C、pH=4时,作垂线交三条曲线,得三个点,Pc(HC2O4-)<Pc(C2O42-)<Pc(H2C2O4),故c(HC2O4-)>c(C2O42-)>c(H2C2O4),故C正确;D、 
 ,故D正确;故选D。
,故D正确;故选D。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
【题目】已知:CO(g) + H2O(g) ![]() H2(g) + CO2(g) 的平衡常数K随温度的变化如下表,下列说法正确的是( )
H2(g) + CO2(g) 的平衡常数K随温度的变化如下表,下列说法正确的是( )
温度/℃ | 400 | 500 | 830 | 1000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
A. 该反应的正反应是吸热反应
B. 恒温时增大压强,正反应速率增大
C. 830℃时,反应达到平衡,一定是c(CO)=c(CO2)
D. 400℃时,生成CO2物质的量越多,平衡常数K越大