题目内容
8.已知下列各物质都是由短周期元素组成,它们之间的关系如图所示: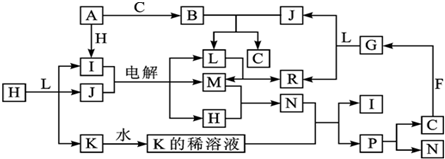
常温下,A、F为金属单质,F既能与L溶液反应,又能与N溶液反应.C、H、M为气体单质,其中H呈黄绿色,A、B、I、K、L、R焰色反应均为黄色.请回答:
(1)P的结构式为H-O-Cl,B的电子式为
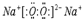 .
.(2)R的水溶液呈碱性的原因可用离子方程式表示为AlO2-+2H2O?Al(OH)3+OH-.
(3)还有一种物质能与B反应生成C,写出这个反应的化学方程式2Na2O2+2CO2═2Na2CO3+O2.
(4)还有一种单质能与J反应生成C,写出这个反应的化学方程式2F2+2H2O═4HF+O2.
(5)某气体Q具有漂白作用,将Q与H等物质的量通入水中所得溶液没有漂白作用,写出该过程中发生反应的离子方程式Cl2+SO2+2H2O═4H++2Cl-+SO42-.
分析 J是常见无色液体,应为H2O,F既能与L溶液反应,又能与N溶液反应,应为Al与酸、碱的反应,则F为Al,H呈黄绿色,应为Cl2,则电解J、I的反应应为电解饱和食盐水,I为NaCl,A为Na,L为NaOH,M为H2,R为NaAlO2,K为NaClO,N为HCl,P为HClO,C为O2,B为Na2O2,G应为H2O2,结合对应物质的性质以及题目要求解答该题.
解答 解:J是常见无色液体,应为H2O,F既能与L溶液反应,又能与N溶液反应,应为Al与酸、碱的反应,则F为Al,H呈黄绿色,应为Cl2,则电解J、I的反应应为电解饱和食盐水,I为NaCl,A为Na,L为NaOH,M为H2,R为NaAlO2,K为NaClO,N为HCl,P为HClO,C为O2,B为Na2O2,G应为H2O2,
(1)通过以上分析知,P为次氯酸,结构式为H-O-Cl,B是Na2O2电子式为: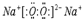 ,
,
故答案为:H-O-Cl,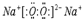 ;
;
(2)R为偏铝酸钠,偏铝酸根离子在水溶液呈碱性的原因是水解,可用离子方程式表示为AlO2-+2H2O═Al(OH)3+OH-,
故答案为:AlO2-+2H2O═Al(OH)3+OH-;
(3)B为Na2O2,C为O2,二氧化碳、水和过氧化钠反应都可以生成氧气,反应的化学方程式为:2Na2O2+2CO2═2Na2CO3+O2,
故答案为:2Na2O2+2CO2═2Na2CO3+O2;
(4)J为H2O,C为O2,还有一种单质能与J反应生成C,判断为F2,反应的化学方程式为:2F2+2H2O═4HF+O2;
故答案为:2F2+2H2O═4HF+O2;
(5)某气体Q为SO2具有漂白作用,H为Cl2,将Q与H等物质的量通入水中所得溶液没有漂白作用,是因为氯气和二氧化硫1:1反应生成硫酸和盐酸,反应的离子方程式为:Cl2+SO2+2H2O═4H++2Cl-+SO42-,
故答案为:Cl2+SO2+2H2O═4H++2Cl-+SO42-;
点评 本题考查了无机物推断,为高考热点题型,根据物质的特殊颜色、状态为突破口进行推断,元素化合物知识学习重点内容,考试时涉及知识面较广泛,题目难度中等.

 发散思维新课堂系列答案
发散思维新课堂系列答案| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
| A. | 该反应的化学方程式是:CO (g)+H2O (g)?CO2 (g)+H2(g) | |
| B. | 上述反应的正反应是放热反应 | |
| C. | 如果在一定体积的密闭容器中加入CO2和H2各1 mol,5 min后温度升高到830℃,此时测得CO2为0.4 mol时,该反应为平衡状态 | |
| D. | 某温度下,如果平衡浓度符合下列关系式:$\frac{c(C{O}_{2})}{3c(CO)}$=$\frac{c({H}_{2}O)}{5c({H}_{2})}$,判断此时的温度是1000℃ |
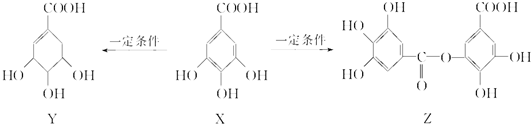
| A. | 1 mol X最多能与2 mol Br2发生取代反应 | |
| B. | Y分子结构中有3个手性碳原子 | |
| C. | 1 mol Z最多能与7 mol NaOH发生反应 | |
| D. | Y能发生加成、取代、消去、氧化、缩聚反应 |
| A. | 2 4 3 2 2 6 | B. | 0 2 1 0 1 2 | ||
| C. | 2 0 1 2 0 2 | D. | 2 2 2 2 1 4 |

| A. | 银镜反应 | B. | 水解反应 | C. | 消去反应 | D. | 酯化反应 |
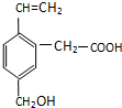
①可以燃烧
②能使酸性KMnO4溶液褪色
③能跟NaOH溶液反应
④能发生酯化反应
⑤能发生加成反应.
| A. | 只有②③④ | B. | 只有①②③④ | C. | ①②③④⑤ | D. | 只有②④ |
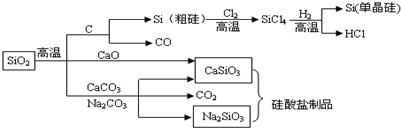
| A. | 图中所有的反应中,属于氧化还原反应的有3个 | |
| B. | 用硫酸可以除去石英砂(主要成分是SiO2)中少量的碳酸钙 | |
| C. | 工业制水泥、工业制玻璃、燃煤固硫等都用到原料石灰石 | |
| D. | 纯净的二氧化硅和单晶硅都是信息产业的重要基础原料,高纯度二氧化硅的广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
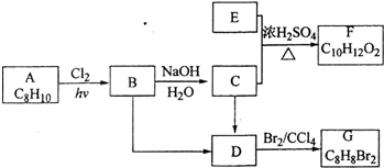

 +H2O
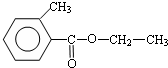
+H2O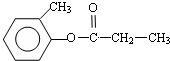 、
、
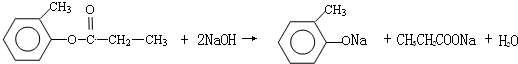 .
. 1,2,3-三苯基环丙烷的3个苯基可以分布在环丙环平面的上下,因此有如下2个异构体.[Φ是苯基,环用键线表示,C、H原子都未画出]据此,可判断1,2,3,4,5-五氯环戊烷(假定五个碳原子也处于同一平面上)的异构体数是( )
1,2,3-三苯基环丙烷的3个苯基可以分布在环丙环平面的上下,因此有如下2个异构体.[Φ是苯基,环用键线表示,C、H原子都未画出]据此,可判断1,2,3,4,5-五氯环戊烷(假定五个碳原子也处于同一平面上)的异构体数是( )