题目内容
1.已知2Fe3++2I-=2Fe2++I2、Br2+2Fe2+=2Fe3++2Br-.现向含有FeBr2、FeI2的某溶液中通入一定量的氯气,再向反应后的溶液中滴加少量的KSCN溶液,结果溶液变为红色,则下列叙述中不正确的是( )①按Br2、Fe3+、I2的顺序氧化性逐渐减弱
②原溶液中Br-一定被氧化
③原溶液中的Fe2+全部被氧化
④还原性:I->Br->Fe2+
⑤若取少量所得溶液,加入CCl4后静置,向上层溶液中加入足量的AgNO3溶液,只产生白色沉淀,说明原溶液中Fe2+、Br-均被完全氧化.
| A. | ①③④ | B. | ②③④ | C. | ②③ | D. | ②④ |
分析 氯气先氧化碘离子,然后氧化二价铁,最后氧化溴离子,向反应后的溶液中滴加KSCN溶液,结果溶液变为红色,说明含有铁离子,则碘离子全部被氧化,二价铁部分或全部被氧化,溴离子可能被氧化,以此解答该题.
解答 解:氯气先氧化碘离子,然后氧化二价铁,最后氧化溴离子,向反应后的溶液中滴加KSCN溶液,结果溶液变为红色,说明碘离子全部被氧化,二价铁部分或全部被氧化,溴离子可能被氧化,
①氯气先氧化碘离子,然后氧化二价铁,最后氧化溴离子,则碘离子还原性最强,溴离子最弱,而氧化性按Br2、Fe3+、I2的顺序逐渐减弱,故正确;
②原溶液中的Br-可能被氧化,也可能未被氧化,故错误;
③通入氯气之后原溶液中的二价铁部分或全部被氧化,故错误;
④由Br2+2Fe2+=2Fe3++2Br-可知还原性Fe2+>Br-,故错误;
⑤若取少量所得溶液,再加入CCl4溶液,静置、分液,向上层溶液中加入足量的AgNO3溶液,只产生白色沉淀,说明原溶液中的Br-被完全氧化,I-、Fe2+均被完全氧化,故正确;
故选B.
点评 本题考查了氧化还原反应中氧化性和还原性强弱的知识,是一道综合性较强的题目,完成本题,需要合理分析题中的信息,得出正确结论,注意推断的严密性,本题难度中等.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
12.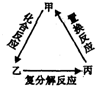 不能实现如图转化的单质甲是( )
不能实现如图转化的单质甲是( )
 不能实现如图转化的单质甲是( )
不能实现如图转化的单质甲是( )| A. | Si | B. | S | C. | Fe | D. | Cu |
9.下列说法正确的是( )
| A. | 铜、石墨均能导电,所以它们均是电解质 | |
| B. | NH3、CO2均是非电解质,所以NH3、CO2的水溶液均不能导电 | |
| C. | 用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液 | |
| D. | 用过滤的方法除去NaCl溶液中含有的少量淀粉胶体 |
6.用NA表示阿伏德罗常数,下列叙述正确的是( )
| A. | 标准状况下,22.4LH2O含有的分子数为1 NA个 | |
| B. | 1mol/L 的MgCl2溶液中,含有Cl-个数为2NA个 | |
| C. | 室温时,1 NA个CO2分子占有的体积为22.4L | |
| D. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02NA个 |
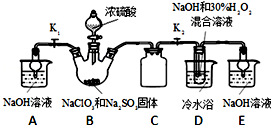
11. 纯碱、烧碱等是重要的化工原料.
纯碱、烧碱等是重要的化工原料.
(1)利用如图所示装置可间接证明二氧化碳与烧碱溶液发生了反应.将A与B连接,打开止水夹,将胶头滴管中的液体挤入烧瓶,此时的实验现象是水沿导管由广口瓶进入烧瓶(或:水倒吸进入烧瓶),反应的离子方程式是2OH-+CO2=CO32-+H2O(或CO2+OH-=HCO3-).若其它操作不变,将A与C连接,可观察到的现象是广口瓶中的长导管口有气泡产生.
(2)向100mL2mol/L的NaOH 溶液中通入一定量CO2,结晶,得到9.3g白色固体,该白色固体的组成是NaOH和Na2CO3(写化学式).
设计实验确认该白色固体中存在的阴离子,试完成下列方案.
(3)在标况下,将4.48L CO2气体通入300mL 1mol/L 的NaOH的稀溶液中,写出该反应的离子方程式(用一个离子方程式表示)2CO2+3OH-=CO32-+HCO3-+H2O.
 纯碱、烧碱等是重要的化工原料.
纯碱、烧碱等是重要的化工原料.(1)利用如图所示装置可间接证明二氧化碳与烧碱溶液发生了反应.将A与B连接,打开止水夹,将胶头滴管中的液体挤入烧瓶,此时的实验现象是水沿导管由广口瓶进入烧瓶(或:水倒吸进入烧瓶),反应的离子方程式是2OH-+CO2=CO32-+H2O(或CO2+OH-=HCO3-).若其它操作不变,将A与C连接,可观察到的现象是广口瓶中的长导管口有气泡产生.
(2)向100mL2mol/L的NaOH 溶液中通入一定量CO2,结晶,得到9.3g白色固体,该白色固体的组成是NaOH和Na2CO3(写化学式).
设计实验确认该白色固体中存在的阴离子,试完成下列方案.
| 实验操作 | 实验现象 | 结论 |
| ①取少量白色固体于试管中,加足量水溶解,再加足量BaCl2溶液 | 产生白色沉淀 | 有CO32- |
| ②过滤,取2mL滤液于试管中 | ||
| ③滴加酚酞 | 溶液变红 | 有OH- |
 常温下,向25mL 0.1mol/L MOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:
常温下,向25mL 0.1mol/L MOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题: