题目内容
13.写出下列反应的离子方程式(1)硫酸钠溶液和氯化钡溶液的反应
(2)氢氧化钠溶液和硫酸的反应
(3)硫酸铜溶液和氢氧化钠溶液的反应
(4)碳酸钠盐酸的反应
(5)铁和稀盐酸的反应.
分析 (1)硫酸钠溶液和氯化钡溶液的反应生成硫酸钡和氯化钠;
(2)氢氧化钠溶液和硫酸的反应生成硫酸钠和水;
(3)硫酸铜溶液和氢氧化钠溶液的反应生成硫酸钠和氢氧化铜;
(4)碳酸钠盐酸的反应生成氯化钠和水、二氧化碳;
(5)铁和稀盐酸的反应生成氯化亚铁和氢气.
解答 解:(1)硫酸钠溶液和氯化钡溶液的反应生成硫酸钡和氯化钠,离子方程式:Ba2++SO42-=BaSO4↓;
故答案为:Ba2++SO42-=BaSO4↓;
(2)氢氧化钠溶液和硫酸的反应生成硫酸钠和水:H++OH-=H2O;
故答案为:H++OH-=H2O;
(3)硫酸铜溶液和氢氧化钠溶液的反应生成硫酸钠和氢氧化铜:Cu2++2OH-=Cu(OH)2↓;
故答案为:Cu2++2OH-=Cu(OH)2↓;
(4)碳酸钠盐酸的反应生成氯化钠和水、二氧化碳:CO32-+2H+=H2O+CO2↑;
故答案为:CO32-+2H+=H2O+CO2↑;
(5)铁和稀盐酸的反应生成氯化亚铁和氢气:Fe+2H+=Fe2++H2↑;
故答案为:Fe+2H+=Fe2++H2↑.
点评 本题考查离子反应的书写,为高频考点,把握发生的化学反应及离子反应的书写方法为解答的关键,侧重复分解反应的离子反应考查,题目难度不大.

练习册系列答案
相关题目
3.在铜-锌-硫酸构成的原电池中,工作一段时间后,下列说法正确的是( )
| A. | 锌片是正极,铜片上有气泡冒出 | B. | 电流方向是从锌片流向铜片 | ||
| C. | 溶液中硫酸的物质的量不断减小 | D. | 电解液的pH保持不变 |
4.焰色反应呈黄色的是( )
| A. | 钠 | B. | 钾 | C. | 钙 | D. | 铜 |
18.下列事实中,能证实一元酸HR是弱电解质的是( )
| A. | HR溶液和KCl溶液不发生反应 | |
| B. | 能与水以任意比例互溶 | |
| C. | 0.1 mol•L-1 的HR溶液中c(R- )=0.01 mol•L-1 | |
| D. | HR属于共价化合物 |
5.X、Y、Z、W是原子序数依次递增的短周期元素,4种元素的原子最外层电子数之和为16,X与其它元素不在同一周期和同一主族,Y的阴离子与Z的阳离子具有相同的电子层结构,且Z为地壳中含量最高的金属元素,W原子得到一个电子后形成与某稀有气体原子核外电子排布相同的稳定结构.下列说法不合理的是( )
| A. | 简单离子半径:W>Y>Z | |
| B. | X、Y与Z形成的化合物中既有极性共价键又有离子键 | |
| C. | Z与Y形成的化合物为一种高温结构陶瓷 | |
| D. | X与Y只能形成10电子分子,不能形成18电子分子 |
2.浓硫酸具有的性质:( )
①脱水性 ②吸水性③强氧化性 ④强酸性 ⑤高沸点.
①脱水性 ②吸水性③强氧化性 ④强酸性 ⑤高沸点.
| A. | 只有①③⑤ | B. | 只有②③④ | C. | 只有③④⑤ | D. | ①②③④⑤均有 |

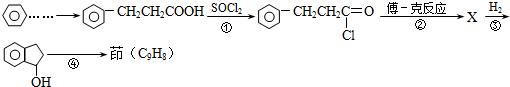
 .
.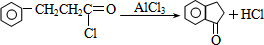 .
.