题目内容
下列实验过程中产生的现象与对应的图形不相符的是


| A.AlCl3溶液滴入 | B.SO2气体通 | C.H2S气体通入 | D.CO2气体通入饱NaOH溶液中入氢硫酸中 NaOH溶液中 和Na2CO3溶液中 |
AD
分析:A、将氯化铝溶液滴加到氢氧化钠溶液中,碱相对于氯化铝过量,开始不会出现沉淀;
B、SO2气体通入氢硫酸中,酸的量开始减少,当硫化氢消耗完毕时,溶液的酸性是由二氧化硫溶于水所导致;
C、H2S气体通入NaOH溶液中,发生酸碱中和反应,溶液中的溶质由氢氧化钠转化为硫化钠;
D、溶液导电能力和溶液中自由移动离子的多少有关.
解:A、将氯化铝溶液滴加到氢氧化钠溶液中,开始阶段发生的反应为:Al3++4OH-═AlO2-+2H2O,开始不会产生沉淀,故A错误.
B、SO2气体通入氢硫酸中,发生的反应为:和2H2S+SO2═3S↓+2H2O,酸的量开始减少,所以酸性减弱,当硫化氢消耗完毕时,溶液的酸性是由二氧化硫溶于水形成的亚硫酸所导致的,所以酸性又会增强,故B正确;
C、H2S气体通入NaOH溶液中,发生反应的方程式为:H2S+2NaOH=Na2S+2H2O,溶液中的溶质随反应的进行由氢氧化钠转化为硫化钠,由方程式看以看出,2molNaOH的质量大于1molNa2S的质量,所以开始阶段溶质的质量减小,当全部生成Na2S后,继续通入硫化氢生成硫氢化钠,然后溶质质量逐渐增大,当Na2S消耗完毕时,溶质质量不再改变,故C正确;
D、把CO2气体通入饱和Na2CO3溶液中,CO2+Na2CO3+H2O=2NaHCO3,会有碳酸氢钠晶体析出,溶液中离子浓度减小了,所以溶液的导电能力也减小,故D错误.
故选AD.

练习册系列答案
 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目
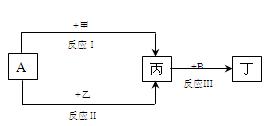
 反应。
反应。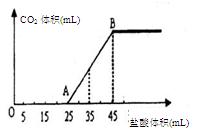

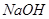 溶液中
溶液中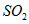 通入
通入
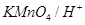 溶液中
溶液中 )错误的是
)错误的是