题目内容
向盛有1 mL 0.1 mol/L MgCl2溶液的试管中滴加1 mL 0.2 mol/L氨水,观察到有白色沉淀生成,再滴加1 mL 0.1 mol/L FeCl3溶液,发现白色沉淀转化为红褐色沉淀。由以上现象可以推知,下列叙述正确的是
c(Cl-)>c(NH4+)>c(Mg2+)>c(Fe3+)>c(OH-)>c(H+)
| A.生成白色沉淀的离子方程式是:Mg2++2OH-="=" Mg(OH)2↓ |
| B.白色沉淀转化为红褐色沉淀的离子方程式是:3Mg(OH)2+2Fe3+==3Mg2++2Fe(OH)3 |
| C.上述实验说明Mg(OH)2的Ksp小于Fe(OH)3的Ksp |
| D.最后所得的溶液中离子浓度大小关系为: |
B
涉及反应为:Mg2++2NH3·H2O=Mg(OH)2↓+2NH4+ 3Mg(OH)2+2Fe3+=3Mg2++2Fe(OH)3
由于Mg(OH)2的Ksp相对较大,发生了沉淀转化;由各物质的量可知最终溶液为NH4Cl、MgCl2溶液,水解呈酸性
答案为B
由于Mg(OH)2的Ksp相对较大,发生了沉淀转化;由各物质的量可知最终溶液为NH4Cl、MgCl2溶液,水解呈酸性
答案为B

练习册系列答案
相关题目
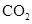
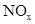 在催化剂表面氧化生成N2
在催化剂表面氧化生成N2
 的关键,不同的化学物质有不同的用途。现有①氯气、②氨气、③单质硅、④水玻璃四种物质。其中可以用作制冷剂的是
的关键,不同的化学物质有不同的用途。现有①氯气、②氨气、③单质硅、④水玻璃四种物质。其中可以用作制冷剂的是 ;常用作木材防火剂材料的是 ;可以用来消毒杀菌的是 。(填序号)
;常用作木材防火剂材料的是 ;可以用来消毒杀菌的是 。(填序号)
 中阳离子与阴离子的个数比为2:1,可推出
中阳离子与阴离子的个数比为2:1,可推出 中阳离宇与阴离子的个数比为1:1
中阳离宇与阴离子的个数比为1:1 ”反应可推出“
”反应可推出“ ”反应也能发生
”反应也能发生