题目内容
【题目】已知:pBa=-lgc(Ba2+),pKa=-lgc(Ka)。已知常温下H2CO3:pKa1=6.4,pKa2=10.3。向20mL 0.1mol·L1 BaCl2溶液中滴加0.2mol·L1 Na2CO3溶液的滴定曲线如图所示。下列说法正确的是

A. E、F、G三点的Ksp从大到小的顺序为:G>F>E
B. 其他条件相同,用MgCl2溶液替代BaCl2溶液,F点向G点迁移
C. 常温下,Ksp(BaCO3)≈1.0×109
D. 常温下,Na2CO3溶液的pKh1=7.6
【答案】C
【解析】
A.Ksp只与温度有关,所以E、F、G三点的Ksp应该相等,A项错误;
B.由于MgCl2和BaCl2均与等物质的量Na2CO3反应,用相同浓度MgCl2溶液替代BaCl2溶液,恰好完全反应时消耗的Na2CO3溶液的体积相同,但由于Ksp(BaCO3)<Ksp(MgCO3),所以pMg<pBa,故点应该在F的正下方,B项错误;
C.F点表示氯化钡溶液和碳酸钠溶液恰好完全反应生成碳酸钡和氯化钠,c(Ba2+)=c(CO32-),Ksp(BaCO3)≈1.0×109,C项正确;
D.CO32-+H2O![]() HCO3-+OH,pKh1=-lg(Kw/Ka2)=3.7,D项错误。
HCO3-+OH,pKh1=-lg(Kw/Ka2)=3.7,D项错误。
本题答案选C。

【题目】决定物质性质的重要因素是物质结构。请回答下列问题:
(1)已知元素M是组成物质Ca5(PO4)3F的一种元素。元素M的气态原子逐个失去第1个至第5个电子所需能量(即电离能,用符号I1至I5表示)如表所示:
I1 | I2 | I3 | I4 | I5 | |
电离能 | 589.8 | 1145.4 | 4912.4 | 6491 | 8153 |
元素M化合态常见化合价是_________价,其基态原子电子排布式为_________。
(2)Ca3(PO4)3F中非金属元素电负性由大到小的顺序为_________。
(3)PO43-的中心原子的杂化方式为_________,该离子的空间构型为_________,键角为________,其等电子体有_________ (请写出两种)。
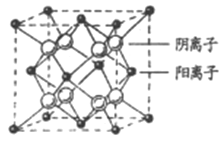
(4)CaF2晶胞结构如图所示,则CaF2晶体中与Ca2+最近且等距离的Ca2+数目为_________;已知Ca2+和F半径分别为a cm、b cm,阿伏加德罗常数为NA,M为摩尔质量,则晶体密度为________g·cm3(不必化简)。
(5)已知MgO与CaO的晶体结构相似,其摩氏硬度的大小关系为_________,原因为___________。