题目内容
某研究性学习小组的同学对Cl2使有色物质褪色的机理进行了探究.甲同学设计了如图所示的实验装置并进行实验:
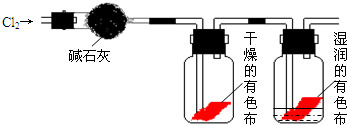
(1)甲同学实验后并没有得到预期的实验现象,请你帮助他分析实验失败的原因
(2)甲同学在实验失败后对设计的实验装置进行了改进,并重新进行了实验,结果得到了预期的实验现象.你认为他预期的实验现象是
(3)乙同学认为甲设计的实验装置即使改进后还缺少一部分.请你将乙认为缺少的部分在上图中的相应位置画出,并在添加的装置中标明需要放入的最合适的化学试剂的名称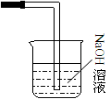
 .
.
(4)请你写出Cl2和“③”中“最合适的化学试剂”反应的离子方程式

(1)甲同学实验后并没有得到预期的实验现象,请你帮助他分析实验失败的原因
使用的干燥剂碱石灰将Cl2吸收
使用的干燥剂碱石灰将Cl2吸收
;(2)甲同学在实验失败后对设计的实验装置进行了改进,并重新进行了实验,结果得到了预期的实验现象.你认为他预期的实验现象是
干燥的有色布条不褪色,湿润的有色布条褪色
干燥的有色布条不褪色,湿润的有色布条褪色
,由此得出Cl2使有色物质褪色的机理是Cl2和水反应生成次氯酸,次氯酸具有漂白作用
Cl2和水反应生成次氯酸,次氯酸具有漂白作用
;(3)乙同学认为甲设计的实验装置即使改进后还缺少一部分.请你将乙认为缺少的部分在上图中的相应位置画出,并在添加的装置中标明需要放入的最合适的化学试剂的名称


(4)请你写出Cl2和“③”中“最合适的化学试剂”反应的离子方程式
Cl2+2OH-=Cl-+ClO-+H2O
Cl2+2OH-=Cl-+ClO-+H2O
.分析:(1)氯气是一种酸性气体,能被碱石灰吸收,导致实验失败;
(2)对实验进行改进,可以用浓H2SO4代替碱石灰,干燥的氯气不能使有干燥的色布条褪色,但遇到湿润的有色布条后,能生成具有漂白性的次氯酸,使有色布条褪色;
(3)氯气有毒,所以缺少尾气处理装置,根据氯气是酸性气体这一特点,用NaOH溶液吸收尾气最合适;
(4)Cl2和NaOH溶液反应就是工业上制漂白液的反应:Cl2+2OH-=Cl-+ClO-+H2O.
(2)对实验进行改进,可以用浓H2SO4代替碱石灰,干燥的氯气不能使有干燥的色布条褪色,但遇到湿润的有色布条后,能生成具有漂白性的次氯酸,使有色布条褪色;
(3)氯气有毒,所以缺少尾气处理装置,根据氯气是酸性气体这一特点,用NaOH溶液吸收尾气最合适;
(4)Cl2和NaOH溶液反应就是工业上制漂白液的反应:Cl2+2OH-=Cl-+ClO-+H2O.
解答:解:(1)因为氯气是一种酸性气体,能被碱石灰吸收,所以得不到预期中的湿润的有色布条褪色的现象,故实验失败的原因是使用的干燥剂碱石灰将Cl2吸收了,
故答案为:使用的干燥剂碱石灰将Cl2吸收;
(2)具有漂白性的是次氯酸,而不是氯气本身.换用适合的干燥剂后,由于通到有色布条上的是干燥的氯气,氯气在干燥的有色布条上不能生成次氯酸,所以干燥的有色布条不褪色;而在湿润的有色布条上可以生成具有漂白性的次氯酸,所以湿润的有色布条褪色.由此得出Cl2使有色物质褪色的机理是Cl2和水反应生成次氯酸,次氯酸具有漂白作用才导致有色布条褪色,
故答案为:干燥的有色布条不褪色,湿润的有色布条褪色; Cl2和水反应生成次氯酸,次氯酸具有漂白作用;
(3)氯气有毒,排入大气会造成污染,所以本题缺少尾气处理装置,氯气是酸性气体,所以用NaOH溶液吸收尾气,图为 ,
,
故答案为: ;
;
(4)氯气和NaOH溶液反应生成NaCl、NaClO、H2O,NaCl、NaClO是可溶性钠盐,故离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O.
故答案为:使用的干燥剂碱石灰将Cl2吸收;
(2)具有漂白性的是次氯酸,而不是氯气本身.换用适合的干燥剂后,由于通到有色布条上的是干燥的氯气,氯气在干燥的有色布条上不能生成次氯酸,所以干燥的有色布条不褪色;而在湿润的有色布条上可以生成具有漂白性的次氯酸,所以湿润的有色布条褪色.由此得出Cl2使有色物质褪色的机理是Cl2和水反应生成次氯酸,次氯酸具有漂白作用才导致有色布条褪色,
故答案为:干燥的有色布条不褪色,湿润的有色布条褪色; Cl2和水反应生成次氯酸,次氯酸具有漂白作用;
(3)氯气有毒,排入大气会造成污染,所以本题缺少尾气处理装置,氯气是酸性气体,所以用NaOH溶液吸收尾气,图为
 ,
,故答案为:
 ;
;(4)氯气和NaOH溶液反应生成NaCl、NaClO、H2O,NaCl、NaClO是可溶性钠盐,故离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O.
点评:本题结合具体的实验设计综合考查了氯气是一种酸性、有毒的气体,而且使有色布条褪色的是HClO,而不是氯气.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
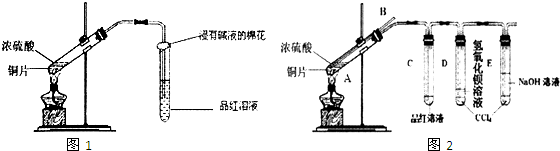
某研究性学习小组为探究Cu与浓H2SO4的反应及其产物SO2的性质,设计如图1实验装置:
(1)写出铜与浓硫酸反应的化学方程式: ;浸有碱液的棉花的作用是 .
(2)该小组同学在实验中发现以上实验装置有相当多不足之处,如实验不够安全和易造成环境污染等.为改进实验和更多地了解SO2的性质,经过同学问的讨论和与老师的交流,设计了如图2实验装置.
①请写出长导管B的作用 (只写一点就可).
②对试管A中的浓H2SO4和铜片进行加热,发现E试管中有气泡逸出,品红溶液很快褪色,但最终未见D试管中氢氧化钡溶液出现浑浊.为探究D试管中未出现浑浊的原因,该小组同学在化学手册中只查阅到下列物质常温下的溶解度数据:
请你应用类比研究方法帮他们预测D试管未出现浑浊的原因: .
③为验证D试管中溶液的组成,进行了下列实验,请你帮他们完成下列实验内容:
(1)写出铜与浓硫酸反应的化学方程式:
(2)该小组同学在实验中发现以上实验装置有相当多不足之处,如实验不够安全和易造成环境污染等.为改进实验和更多地了解SO2的性质,经过同学问的讨论和与老师的交流,设计了如图2实验装置.
①请写出长导管B的作用
②对试管A中的浓H2SO4和铜片进行加热,发现E试管中有气泡逸出,品红溶液很快褪色,但最终未见D试管中氢氧化钡溶液出现浑浊.为探究D试管中未出现浑浊的原因,该小组同学在化学手册中只查阅到下列物质常温下的溶解度数据:
| 物质 | 溶解度(g/100水) | 物质 | 溶解度(g/100水) |
| Ca(OH)2 | 0.173 | Ba(OH)2 | 3.89 |
| CaCO3 | 0.0013 | BaSO3 | 0.016 |
| Ca(HCO3)2 | 16.60 |
③为验证D试管中溶液的组成,进行了下列实验,请你帮他们完成下列实验内容:
| 实验方案 | 现象 |
| 1.取少量溶液于试管中,加入稀盐酸,加热, 用湿润的蓝色石蕊试纸检验生成的气体. |
|
| 2.取少量溶液于试管中,加入 |

 “白铁皮”具有较强的耐腐蚀性,是生产中常用的金属材料之一.镀锌层犹如铁皮的保护层,这层膜的厚度及均匀度也成了判断镀层质量的重要指标.某研究性学习小组为了测定镀锌铁皮的厚度,设计了下面的实验方案:
“白铁皮”具有较强的耐腐蚀性,是生产中常用的金属材料之一.镀锌层犹如铁皮的保护层,这层膜的厚度及均匀度也成了判断镀层质量的重要指标.某研究性学习小组为了测定镀锌铁皮的厚度,设计了下面的实验方案: Al(OH)3+3H+,Cu2++2H2O
Al(OH)3+3H+,Cu2++2H2O Cu(OH)2+2H+,2Al+6H+=2Al3++3H2↑
Cu(OH)2+2H+,2Al+6H+=2Al3++3H2↑