题目内容
【题目】某工厂的尾气主要成分为N2、NO、CO、CO2、SO2等,某兴趣小组设计以下实验,定量检测尾气中污染性气体的含量。
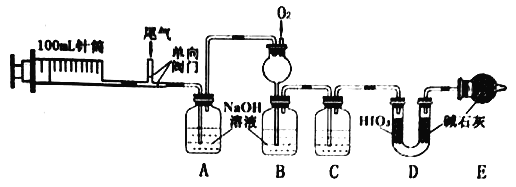
(1)实验时,先推送N2,再连续抽送20次(100mL/次)尾气,最后推送N2。
①第一次推送N2的作用是________。
②尾气采用多次抽送方式的目的是________。
(2)C中的试剂是____________。
(3)装置D用于测量CO。
①HIO3能氧化CO,还原产物为I2,反应的化学方程式为____________。
②D中碱石灰的作用是_________。
(4)为进一步分析SO2含量,将实验后A中溶液转移到烧杯,依次加入三种试剂,过滤、洗涤、干燥。称得沉淀为1.165g。
①加入的三种试剂为_______。(选填序号)
a.盐酸 b.双氧水 c.BaCl2溶液 d.稀硫酸
②检验沉淀是否洗涤干净的方法是_____________。
③尾气中SO2含量为_____gL-1。
(5)实验后,测得B中溶液体积为100mL,NO2-、NO3- 的浓度分别为0.0100molL-1和0.0200molL-1。
①B中长颈漏斗的作用是_____________;
②通入O2的体积(标准状况)至少为___________mL。
【答案】 排尽装置中的空气 减小相对误差 浓硫酸 2HIO3+ 5CO = I2 + 5CO2 + H2O 吸收 CO2和 H2O abc 取最后一次洗涤液少许于试管中,加入硝酸酸化的AgNO3溶液, 若无白色沉淀生成,则沉淀洗涤干净,反之沉淀未洗净 0.16 使 NO 和O2充分混合, 防止倒吸 39.2
【解析】本题考查实验方案设计与评价,(1)①第一次通入N2的目的排尽装置中的空气,防止NO与O2发生反应;②尾气采用多次抽送方式,其目的是减小相对误差;(2)装置DHIO3把CO氧化成CO2,装置E吸收CO2,从而计算CO的量,从B中出来的气体中含有水蒸气,能被碱石灰吸收,干扰CO量的测定,因此装置C中盛放的试剂为浓硫酸;(3)①HIO3把CO氧化成CO,本身被还原成I2,即HIO3+CO→CO2+I2+H2O,根据化合价升降进行配平,化学反应方程式为2HIO3+ 5CO = I2 + 5CO2 + H2O;②碱石灰的作用是吸收装置D中产生的CO2和H2O;(4)①装置A中NaOH吸收SO2和CO2,转化成Na2SO3和Na2CO3,测定SO2,应向A溶液中加入盐酸,除去Na2CO3,然后滴加H2O2,把+4价S氧化成SO42-,最后滴加BaCl2溶液,生成BaSO4沉淀;②沉淀表面为NaCl,证明沉淀已洗净的方法是取最后一次洗涤液少许于试管中,加入硝酸酸化的AgNO3溶液, 若无白色沉淀生成,则沉淀洗涤干净,反之沉淀未洗净;③根据硫元素守恒,n(SO2)=n(BaSO4)=1.165/233mol=0.005mol,因此尾气中SO2的含量为![]() ;(5)①B中长颈漏斗的作用是使NO和O2充分混合,以及防止倒吸;②发生的反应是2NO+O2=2NO2、2NO2+2NaOH=NaNO2+NaNO3+H2O,还有一部分氧气把部分NaNO2氧化成NaNO3,根据得失电子数目守恒,有n(O2)×4=n(NO2-)×1+n(NO3-)×3=100×10-3×0.01×1+100×10-3×0.02×3,解出n(O2)=1.75×10-3mol,即氧气体积至少为1.75×10-3×22.4×10-3mL=39.2mL。
;(5)①B中长颈漏斗的作用是使NO和O2充分混合,以及防止倒吸;②发生的反应是2NO+O2=2NO2、2NO2+2NaOH=NaNO2+NaNO3+H2O,还有一部分氧气把部分NaNO2氧化成NaNO3,根据得失电子数目守恒,有n(O2)×4=n(NO2-)×1+n(NO3-)×3=100×10-3×0.01×1+100×10-3×0.02×3,解出n(O2)=1.75×10-3mol,即氧气体积至少为1.75×10-3×22.4×10-3mL=39.2mL。

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案