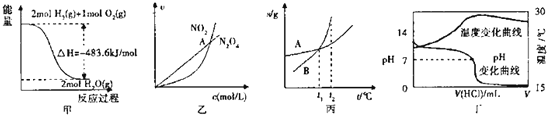
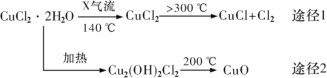题目内容
【题目】25°C时, Ksp (AgCl)= 1.56×10-10, Ksp(Ag2CrO4)= 9.0×10-12,下列说法正确的是
A. AgCl 和 Ag2CrO4 共存的悬浊液中,![]()
B. 向Ag2CrO4悬浊液中加入 NaCl 浓溶液, Ag2CrO4不可能转化为 AgCl
C. 向 AgCl 饱和溶液中加入 NaCl 晶体, 有 AgC1 析出且溶液中 c(Cl-)=c(Ag+)
D. 向同浓度的 Na2CrO4和 NaCl 混合溶液中滴加 AgNO3溶液,AgC1先析出
【答案】D
【解析】A、AgCl 和 Ag2CrO4 共存的溶液中,c(Ag+)是相等的,但由于二者的组成比不同,Ksp的表达式不同,因此c(Cl-)/ c(CO42-)不等于二者的Ksp之比,故A错误;B、根据Ksp的含义,向Ag2CrO4悬浊液中加入NaCl浓溶液,当溶液中c(Cl-) c(Ag+)> Ksp (AgCl)时,就有AgCl沉淀析出,所以B错误;C、向AgCl饱和溶液中加入NaCl晶体,使溶液中c(Cl-)增大,导致c(Cl-) c(Ag+)> Ksp (AgCl),从而析出AgC1,析出沉淀后的溶液中c(Cl-)> c(Ag+),所以C错误;D、向同浓度的Na2CrO4和NaCl混合溶液中滴加AgNO3溶液,根据Ksp计算可得,生成AgCl沉淀需要的c(Ag+)= 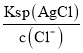 =
=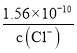 ,生成Ag2CrO4沉淀需要的c(Ag+)=
,生成Ag2CrO4沉淀需要的c(Ag+)= 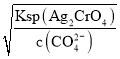 =
= 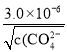 ,前者小于后者,即先析出AgCl沉淀,故D正确。本题正确答案为D。
,前者小于后者,即先析出AgCl沉淀,故D正确。本题正确答案为D。

 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案【题目】治理SO2、CO、NOx污染是化学工作者研究的重要课题。
Ⅰ.软锰矿(MnO2)、菱锰矿(MnCO3)吸收烧结烟气中的SO2制取硫酸锰。pH值对SO2吸收率的影响如图所示。在吸收过程中,氧气溶解在矿浆中将 H2SO3氧化成硫酸。
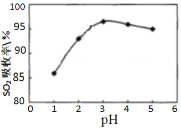
(1)SO2的吸收率在pH=_____效果最佳,MnO2所起的作用是_______,菱锰矿作为调控剂与硫酸反应, 确保pH的稳定,该反应的化学方程式为___________。
Ⅱ.沥青混凝土可作为2CO(g)+O2(g)![]() 2CO2(g)反应的催化剂。图表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
2CO2(g)反应的催化剂。图表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
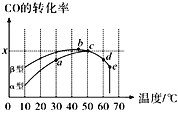
(2)CO转化反应的平衡常数K(a)____K(c)(填“>”“<”或“=”,下同),在均未达到平衡状态时,同温下β型沥青混凝土中CO转化速率___α型,e点转化率出现突变的原因可能是______。
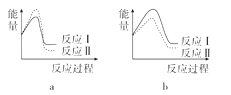
Ⅲ.N2H4是一种具有强还原性的物质。燃烧过程中释放的能量如下:(已知a>b)
① N2H4(g)+2O2(g) == NO2(g)+1/2N2(g)+2H2O(g) ΔH1=a kJ·mol-1
② N2H4(g)+2O2(g) == 2NO(g)+2H2O(g) ΔH2=b kJ·mol-1
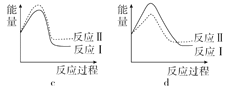
(3)已知反应活化能越低,反应速率越大。假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是______。
(4)试写出NO(g)分解生成N2(g)和NO2(g)的热化学方程式为_____________。
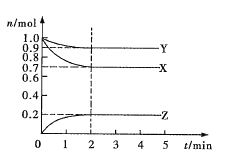
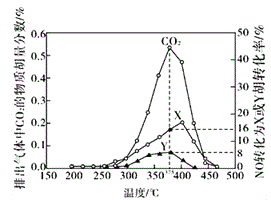
Ⅳ.某含钴催化剂可以催化消除柴油车尾气中的碳烟(C)和NOx。不同温度下,将模拟尾气(成分如下表所示)以相同的流速通过该催化剂,测得所有产物(CO2、N2、N2O)与NO的相关数据结果如下图所示。
模拟尾气 | 气体(10mol) | 碳烟 | ||
NO | O2 | He | ||
物质的量(mol) | 0.025 | 0.5 | 9.475 | n |
(5)375℃时,测得排出的气体中含0.45 molO2和0.0525mol CO2,则Y的化学式为_____。实验过程中不采用NO2的模拟NOx原因是_________。
【题目】2009年10月1日,我国成功举办国庆六十年阅兵活动。其中阅兵仪式上9辆电动车与混合动力车等新能源车辆的亮相,展示了综合国力、国防科技发展水平。同时也说明能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ: CO(g) + 2H2(g)![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ: CO2(g) + 3H2(g)![]() CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
①上述反应符合“原子经济”原则的是 _____(填“Ⅰ”或“Ⅱ”)。
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断ΔH1 0 (填“>”、“=”或“<”)。
③某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为 ,此时的温度为 (从上表中选择)。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1=-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2=-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH3=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(3)某实验小组依据甲醇燃烧的反应原理,
①设计如图所示的电池装置。该电池正极的电极反应为 。

②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为
。