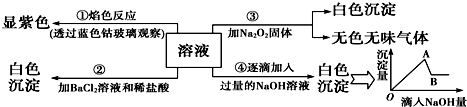
题目内容
6.在容积不变的密闭容器中进行如下反应:N2(g)+3H2(g)?2NH3(g),若将平衡体系中各物质的浓度都增加到原来的2倍,则产生的结果是( )| A. | 平衡不发生移动 | B. | 平衡沿着逆反应方向移动 | ||
| C. | 正逆反应速率都增大 | D. | NH3的质量分数减小 |
分析 若将平衡体系中各物质的浓度都增加到原来的2倍,则应缩小体积,增大压强,则平衡向正反应方向移动,以此来解答.
解答 解:反应前气体化学计量数之和大于反应后气体的化学计量数之和,若将平衡体系中各物质的浓度都增加到原来的2倍,则应缩小体积,增大压强,则平衡向正反应方向移动,
A.平衡正向移动,故A错误;
B.由上述分析可知,平衡正向移动,故B错误;
C.压强增大,正逆反应速率均增大,故C正确;
D.平衡正向移动,NH3的质量分数增加,故D错误;
故选C.
点评 本题考查化学平衡的影响因素,题目难度不大,本题注意浓度、压强对化学平衡的影响,把握浓度的变化转化为压强问题是解答的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
18.对下列反应类型判断正确的是( )
| A. | CH3COOH+C2H5OH→CH3COOCH2CH3+H2O 取代反应 | |
| B. | CH2=CH2+O2→CH3COOH 加成反应 | |
| C. | CH3CH2OH+CH3CH2OH→CH3CH2OCH2CH3+H2O 酯化反应 | |
| D. | C6H6+HNO3→C6H5-NO2+H2O 氧化反应 |
1.《化学反应原理》模块从不同的视角对化学反应进行了探究、分析.以下观点中不正确的是( )
①放热反应在常温下均能自发进行; ②电解过程中,化学能转化为电能而“储存”起来;
③原电池工作时所发生的反应一定有氧化还原反应; ④加热时,放热反应的v(正)会减小;
⑤盐类均能发生水解反应; ⑥化学平衡常数的表达式与化学反应方程式的书写无关.
①放热反应在常温下均能自发进行; ②电解过程中,化学能转化为电能而“储存”起来;
③原电池工作时所发生的反应一定有氧化还原反应; ④加热时,放热反应的v(正)会减小;
⑤盐类均能发生水解反应; ⑥化学平衡常数的表达式与化学反应方程式的书写无关.
| A. | ①②④⑤⑥ | B. | ①④⑤⑥ | C. | ②③⑤⑥ | D. | ①②④⑤ |
11.下列事实不能用勒夏特列原理解释的是( )
| A. | 工业制取金属钾:Na(l)+KCl(l)?NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来 | |
| B. | 配制氯化铁溶液时,将氯化铁加入盐酸中,然后加水稀释 | |
| C. | 向氯水中加CaCO3后,溶液漂白性增强 | |
| D. | 二氧化氮与四氧化二氮的平衡体系,加压缩小体积后颜色加深 |
18.下列离子方程式中正确的是( )
| A. | 小苏打溶液中加入烧碱溶液:HCO3-+OH-═H2O+C02↑ | |
| B. | 氯化铝溶液中加入过量氨水:Al3++3OH-=Al(OH)3↓ | |
| C. | 向氯化亚铁溶液中加入氯水:2Fe2++Cl2═2Fe3++2Cl- | |
| D. | 二氧化碳通入碳酸钠溶液中:CO2+CO32-+H2O═2HCO3- |
15.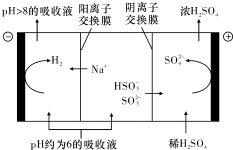 直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.
直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.
(1)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是2OH-+SO2=SO32-+H2O
(2)吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
①上表判断NaHSO3溶液显酸性性;
②当吸收液呈中性时,溶液中离子浓度关系正确的是ab(选填字母):
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(3)当吸收液的pH降至约为6时,需送至电解槽再生.再生示意图如图:HSO${\;}_{3}^{-}$在阳极放电的电极反应式是HSO3-+H2O-2e-=SO42-+3H+.
 直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.
直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.(1)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是2OH-+SO2=SO32-+H2O
(2)吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
②当吸收液呈中性时,溶液中离子浓度关系正确的是ab(选填字母):
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(3)当吸收液的pH降至约为6时,需送至电解槽再生.再生示意图如图:HSO${\;}_{3}^{-}$在阳极放电的电极反应式是HSO3-+H2O-2e-=SO42-+3H+.
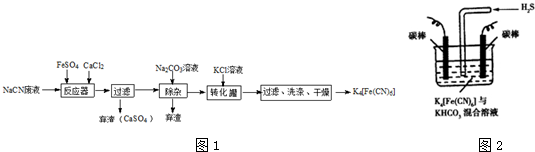
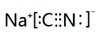 ;
;