��Ŀ����
����Ŀ��D��һ�ִ���ҩ��F��һ�����ϣ����ǵĺϳ�·�����£�
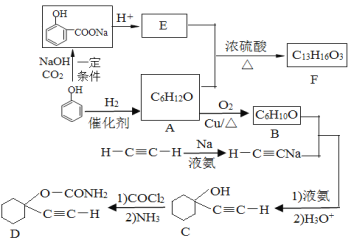
��1��A�Ļ�ѧ������___________��C�к��������ŵ�����Ϊ__________��
��2��F�Ľṹ��ʽΪ____________________________��
��3��A����B�Ļ�ѧ����ʽΪ_______________________________��
��4��д����C�ϳ�D�ĵڶ�����Ӧ�Ļ�ѧ����ʽ_____________________��
��5��ͬʱ��������������E��ͬ���칹����_____________�֣����������칹����
����FeCl3��Һ������ɫ��Ӧ ���ܷ���������Ӧ
��6������Ȳ�ͼ�ȩΪ��ʼԭ�ϣ�ѡ�ñ�Ҫ�����Լ��ϳ�1��3-����ϩ��д���ϳ�·�ߣ��ýṹ��ʽ��ʾ�л���ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��ͷ�Ӧ������_________��
���𰸡������� �ǻ� 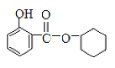 2
2![]() +O2
+O2![]()
![]() +2H2O
+2H2O ![]() +NH3��
+NH3�� +HCl 9
+HCl 9 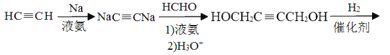 HOCH2CH2CH2CH2OH
HOCH2CH2CH2CH2OH![]() CH2=CHCH=CH2
CH2=CHCH=CH2
��������
![]() ���ᷴӦ�õ�E��EΪ
���ᷴӦ�õ�E��EΪ![]() �����A�ķ���ʽ��֪���������������ӳɷ�Ӧ����A����AΪ
�����A�ķ���ʽ��֪���������������ӳɷ�Ӧ����A����AΪ![]() ��E��A����������Ӧ����F��FΪ
��E��A����������Ӧ����F��FΪ![]() ����������������������B��BΪ
����������������������B��BΪ![]() ���Ա�B��C�Ľṹ����֪H-C��CNa�뻷��ͪ�ȷ����ӳɷ�Ӧ�����ǻ���Ȼ���ữ����C���Ա�C��D�ṹ����֪��һ����C�з��ǻ���Hԭ�ӱ�-COCl������ڶ�������ԭ�ӱ�����������ݴ˷������
���Ա�B��C�Ľṹ����֪H-C��CNa�뻷��ͪ�ȷ����ӳɷ�Ӧ�����ǻ���Ȼ���ữ����C���Ա�C��D�ṹ����֪��һ����C�з��ǻ���Hԭ�ӱ�-COCl������ڶ�������ԭ�ӱ�����������ݴ˷������
(1)AΪ![]() ����ѧ�����ǻ�������C(
����ѧ�����ǻ�������C(![]() )�к��������ŵ�����Ϊ�ǻ����ʴ�Ϊ�����������ǻ���
)�к��������ŵ�����Ϊ�ǻ����ʴ�Ϊ�����������ǻ���
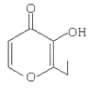
(2)�ɷ�����֪��F�Ľṹ��ʽΪ��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
(3)A����B�ǻ����������Ĵ���������Ӧ�Ļ�ѧ����ʽΪ��2![]() +O2
+O2 ![]() 2
2![]() +2H2O���ʴ�Ϊ��2
+2H2O���ʴ�Ϊ��2![]() +O2
+O2 ![]() 2
2![]() +2H2O��
+2H2O��
(4)�Ա�C��D�ṹ����֪��һ����C�з��ǻ���Hԭ�ӱ�-COCl������ڶ�������ԭ�ӱ������������C�ϳ�D�ĵڶ���Ӧ�Ļ�ѧ����ʽΪ![]() +NH3��
+NH3��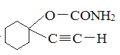 +HCl���ʴ�Ϊ��
+HCl���ʴ�Ϊ��![]() +NH3��
+NH3�� +HCl��
+HCl��
(5)ͬʱ��������������E(![]() )��ͬ���칹�壺����FeCl3��Һ������ɫ��Ӧ��˵�����з��ǻ������ܷ���������Ӧ��˵������ȩ������˽ṹ���������2��ȡ����Ϊ��-OH��-OOCH�����ڡ��䡢��3�֣��������3��ȡ����Ϊ��2��-OH��1��-CHO����2��-OH���ڡ��䡢��3��λ�ã���Ӧ��-CHO�ֱ���2�֡�3�֡�1��λ�ã��ʷ���������ͬ���칹�干��3+2+3+1=9�֣��ʴ�Ϊ��9��
)��ͬ���칹�壺����FeCl3��Һ������ɫ��Ӧ��˵�����з��ǻ������ܷ���������Ӧ��˵������ȩ������˽ṹ���������2��ȡ����Ϊ��-OH��-OOCH�����ڡ��䡢��3�֣��������3��ȡ����Ϊ��2��-OH��1��-CHO����2��-OH���ڡ��䡢��3��λ�ã���Ӧ��-CHO�ֱ���2�֡�3�֡�1��λ�ã��ʷ���������ͬ���칹�干��3+2+3+1=9�֣��ʴ�Ϊ��9��
(6)�����������ͼ����Ȳ��Na��Һ�������·�Ӧ�õ�NaC��CNa��Ȼ����HCHO��Һ������������µõ�HOCH2C��CCH2OH���������������ӳɷ�Ӧ�õ�HOCH2CH2CH2CH2OH�������Ũ���ᡢ���������·�����ȥ��Ӧ����1��3-����ϩ���ϳ�·��Ϊ��HC��CH![]() NaC��CNa
NaC��CNa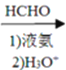 HOCH2C��CCH2OH
HOCH2C��CCH2OH![]() HOCH2CH2CH2CH2OH
HOCH2CH2CH2CH2OH![]() CH2=CHCH=CH2���ʴ�Ϊ��HC��CH
CH2=CHCH=CH2���ʴ�Ϊ��HC��CH![]() NaC��CNa
NaC��CNa HOCH2C��CCH2OH
HOCH2C��CCH2OH![]() HOCH2CH2CH2CH2OH
HOCH2CH2CH2CH2OH![]() CH2=CHCH=CH2��
CH2=CHCH=CH2��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��ij��ȤС���Ʊ�һ��������������.ȡ3mL��ˮ�Ҵ�,2mLŨ����,2mL���������ʵ�飬��5mL����̼������Һ�ռ�����.

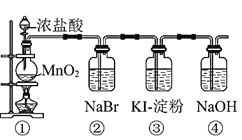
I.ʵ��װ����ͼ��ʾ
��1���Ʊ����������Ļ�ѧ����ʽΪ____________��
��2��Ũ�����������_________��
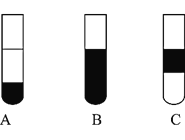
��3������װ�û���ѡ����ͼ�е�_______��������ţ�.

��.��ͬѧ�ú��з�̪�ı���̼������Һ���ʼ��ԣ��ռ�����������ֺ�ɫѸ����ȥ.
��ͬѧ��Ϊ�������������к���̼����.��ͬѧͨ���������ϲ���������ʵ�飬֤����ͬѧ���Ʋ��Ǵ���ġ�
��֪����̪������ˮ���������л��ܼ�����̪�Լ��Ƿ�̪���Ҵ���Һ.
ʵ��i��ȡ����²���ɫҺ�壬�ֳ����ݣ��ֱ��������ʵ��
��� | ʵ����� | ʵ������ | ���� |
1 | �μӼ�����̪�Լ� | ��Һ______������������������������ | ̼���Ʋ�δ��������ȫ�кͣ����д���ʣ�� |
2 | ����������Һ | �д������ݲ� |
ʵ��ii.ȡ����ϲ�Һ�壬����____��Һ�������ֳ���dz��ɫ�����÷ֲ���ɫ��ʧ��
ʵ��iii��ȡ5mL����̼������Һ�����뼸�η�̪�Լ����ټ���3mL�����������������ᣩ����Һ�ȱ�죬���ɫ��ʧ���ش���������
��4���������ʵ�飺��________����________��
��5�����ʵ��ii��ʵ��iii�����ɵó��Ľ�����__________��
��6��ʵ��iii��ʵ��Ŀ����___________��
����Ŀ������ˮ��ɽ���ǽ�ɽ��ɽ��������о�NOx��SO2�ȴ�����Ⱦ������ƴ���������Ҫ���塣
SO2���ŷ���Ҫ������ú��ȼ�գ���ҵ�ϳ��ð�ˮ���շ�����β���е�SO2����֪���չ�������ط�Ӧ���Ȼ�ѧ����ʽ���£�
��SO2(g)+NH3��H2O(aq)=NH4HSO3(aq) ��H1=akJ/mo1��
��NH3��H2O(aq)+NH4HSO3(aq)=(NH4)2SO3(ag)+H2O(l) ��H2=b kJ/mo1��
��2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq) ��H3=c kJ/mo1��
��Ӧ2SO2(g)+4NH3��H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O ��H
(1)��H =______kJ/mo1 (�ú�a��b��c�Ĵ���ʽ��ʾ)��
(2)���ڷ�Ӧ��C(s)+2NO(g)![]() N2(g)+CO2(g) ��H =-34.0kJ/mol����T1��ʱ��������������÷�Ӧ�ڲ�ͬʱ����ϸ����ʵ�Ũ�����£�
N2(g)+CO2(g) ��H =-34.0kJ/mol����T1��ʱ��������������÷�Ӧ�ڲ�ͬʱ����ϸ����ʵ�Ũ�����£�
ʱ�� Ũ�ȣ�mol/L�� | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
��0~10min�ڣ�CO2��ƽ����Ӧ�ٶ�v(CO2)=________��
��30min��ֻ�ı�ijһ��������Ӧ���´ﵽƽ�⣻�����ϱ��е������жϸı������������_______(����ĸ)��
a.����һ�����Ļ���̿ b.ͨ��һ������NO
c.�ʵ���С��������� d.������ʵĴ���
(3)�û���̿��ԭ������NO���йط�ӦΪ��C(s)+2NO(g)![]() N2(g)+CO2(g) ��H =-34.0kJ/mo1����֪��һ���������ܱ������У�����������C��һ������NO���壬���NO��ת�������¶ȵı仯����ͼ��ʾ��
N2(g)+CO2(g) ��H =-34.0kJ/mo1����֪��һ���������ܱ������У�����������C��һ������NO���壬���NO��ת�������¶ȵı仯����ͼ��ʾ��

����ͼ��֪��1050Kǰ��Ӧ��NO��ת�������¶����߶�������ԭ��Ϊ________��
����1100Kʱ��CO2���������Ϊ________��
(4)Ϊ��������β���е��к�����Դ�������Ⱦ�����������װβ������װ�á��ھ���װ����CO��NO������Ӧ2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ��H =-746.8 kJ/mo1����������N2��CO2��ʵ���ã�v��=k����c2(NO)��c2(CO)��v��=k����c(N2)��c2(CO2) (k����k��Ϊ���ʳ�����ֻ���¶��й�)��
N2(g)+2CO2(g) ��H =-746.8 kJ/mo1����������N2��CO2��ʵ���ã�v��=k����c2(NO)��c2(CO)��v��=k����c(N2)��c2(CO2) (k����k��Ϊ���ʳ�����ֻ���¶��й�)��
�ٴﵽƽ��������¶ȣ�k������ı���____(����>����<������=��) k������ı�����
������2L���ܱ������г���2molCO��2molNO����һ���¶��´ﵽƽ��ʱ��CO��ת����Ϊ50%����![]() _______��
_______��