题目内容
按要求完成下列各题.
(1)向澄清石灰水中通入CO2(写出离子方程式)______
(2)用稀硫酸洗铁锈(Fe2O3)(写出离子方程式)______
(3)2Al+6H+═2Al3++3H2↑(写出对应的化学方程式并用双线桥法标出电子转移情况)______.
(1)向澄清石灰水中通入CO2(写出离子方程式)______
(2)用稀硫酸洗铁锈(Fe2O3)(写出离子方程式)______
(3)2Al+6H+═2Al3++3H2↑(写出对应的化学方程式并用双线桥法标出电子转移情况)______.
(1)向澄清石灰水中通入CO2反应生成碳酸钙和水,该离子反应为CO2+Ca2++20H-═CaCO3↓+H2O,
故答案为:CO2+Ca2++20H-═CaCO3↓+H2O;
(2)用稀硫酸洗铁锈(Fe2O3反应生成硫酸铁和水,该离子反应为Fe2O3+6H+═2Fe3++3H2O,
故答案为:Fe2O3+6H+═2Fe3++3H2O;
(3)Al与盐酸的离子反应为2Al+6H+═2Al3++3H2↑,该反应为2Al+6HCl=2AlCl3+3H2↑,该反应中Al元素由0升高为+3价,H元素由+1价降低为0,双线桥法标出电子转移为
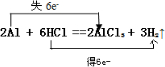
,
故答案为:

.
故答案为:CO2+Ca2++20H-═CaCO3↓+H2O;
(2)用稀硫酸洗铁锈(Fe2O3反应生成硫酸铁和水,该离子反应为Fe2O3+6H+═2Fe3++3H2O,
故答案为:Fe2O3+6H+═2Fe3++3H2O;
(3)Al与盐酸的离子反应为2Al+6H+═2Al3++3H2↑,该反应为2Al+6HCl=2AlCl3+3H2↑,该反应中Al元素由0升高为+3价,H元素由+1价降低为0,双线桥法标出电子转移为

,
故答案为:

.

练习册系列答案
 53天天练系列答案
53天天练系列答案
相关题目





 的分子式是
的分子式是 有机物Y是X的同分异构体,且属于芳香烃,写出Y的结构简式
有机物Y是X的同分异构体,且属于芳香烃,写出Y的结构简式