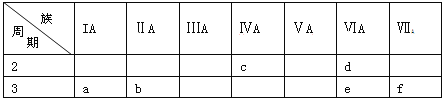
题目内容
【题目】一定温度下,水溶液中H+和OH-的浓度变化曲线如图,下列说法正确的是

A升高温度,可能引起由c向b的变化
B该温度下,水的离子积常数为1.0×10-13
C该温度下,加入FeCl3可能引起由b向a的变化
D该温度下,稀释溶液可能引起由c向d的变化
【答案】C
【解析】
试题分析:在曲线上,A、升高温度促进水的电离,氢离子和氢氧根浓度均增大,因此不能引起由c向b的变化,A错误;B.水的离子积常数K=c(H+)·c(OH-),从图可知离子积是1.0×10-14,不是1.0×10-13,B错误;C.加入FeCl3,水解使得溶液酸性增强,c(H+)增大,c(OH-)减小,则可能引起由b向a的变化,C正确;D.温度不变,水的离子积不变,稀释溶液后所表示的点还在曲线上,不可能引起由c向d的变化,D错误;答案选C。

 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案【题目】研究大气中含硫化合物和含碳化合物的转化对环境保护具有重要意义。
(1)SO2的大量排放会引起严重的环境问题是 ,潮湿条件下,写出大气中SO2转化为HSO3-的方程式 ;
(2)土壤中的微生物可将大气中H2S经两步反应氧化成SO42-,两步反应的能量变化示意图如下:

1mol H2S(g)全部氧化成SO42-(aq)的热化学方程式为 ;
(3)SO2是工业制硫酸的原料之一,一定温度下,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应:2SO2(g)+O2(g)![]() 2SO3(g),过程中测定的部分数据见下表:
2SO3(g),过程中测定的部分数据见下表:
时间/min | n(SO2)/mol | n(O2)/mol |
0 | 0.10 | 0.05 |
4 | 0.04 | 0.02 |
6 | 0.02 | |
8 | 0.01 |
①反应在0-4min内的平均速率为v(SO2)= ;
②此温度下该反应的化学平衡常数K= ;
③8min时,维持温度不变,向反应容器中再通入0.02mol SO2(g)和0.01mol O2(g),重新达到平衡时混合气体中SO2的百分含量将 (填“减小”、“增大”或“不变”)。
(4)科学家用氮化镓材料与铜组装如下图的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4的反应。

写出铜电极表面的电极反应式 ,为提高该人工光合系统的工作效率,可向装置中加入少量 (填“盐酸”或“硫酸”)。