题目内容
【题目】研究大气中含硫化合物和含碳化合物的转化对环境保护具有重要意义。
(1)SO2的大量排放会引起严重的环境问题是 ,潮湿条件下,写出大气中SO2转化为HSO3-的方程式 ;
(2)土壤中的微生物可将大气中H2S经两步反应氧化成SO42-,两步反应的能量变化示意图如下:

1mol H2S(g)全部氧化成SO42-(aq)的热化学方程式为 ;
(3)SO2是工业制硫酸的原料之一,一定温度下,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应:2SO2(g)+O2(g)![]() 2SO3(g),过程中测定的部分数据见下表:
2SO3(g),过程中测定的部分数据见下表:
时间/min | n(SO2)/mol | n(O2)/mol |
0 | 0.10 | 0.05 |
4 | 0.04 | 0.02 |
6 | 0.02 | |
8 | 0.01 |
①反应在0-4min内的平均速率为v(SO2)= ;
②此温度下该反应的化学平衡常数K= ;
③8min时,维持温度不变,向反应容器中再通入0.02mol SO2(g)和0.01mol O2(g),重新达到平衡时混合气体中SO2的百分含量将 (填“减小”、“增大”或“不变”)。
(4)科学家用氮化镓材料与铜组装如下图的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4的反应。

写出铜电极表面的电极反应式 ,为提高该人工光合系统的工作效率,可向装置中加入少量 (填“盐酸”或“硫酸”)。
【答案】(1)酸雨 SO2+H2O![]() HSO3-+H+
HSO3-+H+
(2)H2S(g)+2O2(g)=SO42-(aq)+2H+(aq) ΔH=-806.39KJ/mol
(3)①7.5×10-3mol/(L·min) ②200 ③减小
(4)CO2+8H++8e-=CH4+2H2O 硫酸
【解析】
试题分析:(1)SO2的大量排放会引起严重的环境问题是形成酸雨,二氧化硫为酸性氧化物与水生成亚硫酸,亚硫酸为弱电解质,部分电离产生氢离子与亚硫酸氢根离子,离子方程式:SO2+H2O![]() H2SO3;H2SO3
H2SO3;H2SO3![]() H++HSO3-;
H++HSO3-;
(2)由图可知,第一步热化学反应为:H2S(g)+0.5O2(g)=S(s)+H2O(g)△H=-221.19 kJmol-1;第二步反应为:S(s)+1.5O2(g)+H2O(g)=2H+(aq)+SO42-(aq))△H=-585.20 kJmol-1;依据盖斯定律,第一步与第二步方程式相加得:H2S(g)+2O2(g)=SO42-(aq)+2H+(aq)△H=-806.39 kJmol-1;
(3)①0-4min二氧化硫物质的量变化为0.10mol-0.040mol=0.060mol,反应速率v=![]() =7.5×10-3mol/(Lmin);
=7.5×10-3mol/(Lmin);
②结合图表数据,5min时n(O2)=![]() =0.04mol,剩余氧气物质的量=0.05mol-0.04mol=0.01mol,6min时氧气物质的量为0.01mol,说明5分钟反应达到平衡状态,结合化学平衡三行计算列式计算平衡浓度,5min时,
=0.04mol,剩余氧气物质的量=0.05mol-0.04mol=0.01mol,6min时氧气物质的量为0.01mol,说明5分钟反应达到平衡状态,结合化学平衡三行计算列式计算平衡浓度,5min时,
2SO2(g)+O2(g)![]() 2SO3(g),
2SO3(g),
起始量(mol) 0.1 0.05 0
变化量(mol) 0.08 0.04 0.04
平衡量(mol) 0.02 0.01 0.04
平衡常数=![]() =
=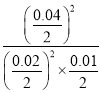 =200(mol/L);
=200(mol/L);
③8min时,维持温度不变,往反应容器中再通入0.020mol SO2(g),0.010mol O2(g),Qc=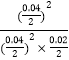 =100<K,反应正向进行,平衡移动程度小重新达到平衡时混合气体中SO2的百分含量将减小;
=100<K,反应正向进行,平衡移动程度小重新达到平衡时混合气体中SO2的百分含量将减小;
(4)①由电池装置图可知,Cu上二氧化碳得电子生成甲烷,则Cu极上的电极反应为:CO2+8e-+8H+=CH4+2H2O;
②可向装置中加入少量的酸作电解质,由于盐酸易挥发,生成的甲烷中会混有HCl气体,所以选用硫酸,不用盐酸;

 备战中考寒假系列答案
备战中考寒假系列答案