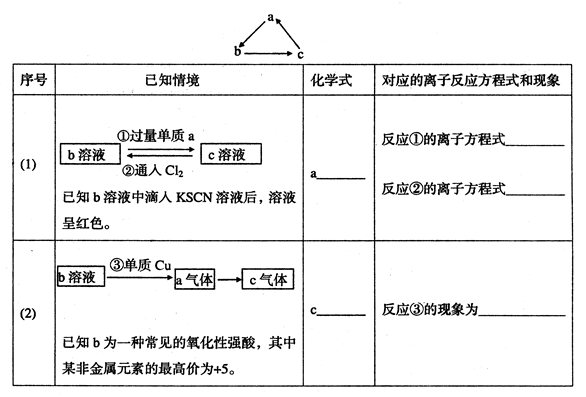
题目内容
常温下,将铁片放入下列溶液中,能观察到有大量气泡产生的是


| A.浓硫酸 | B.稀硫酸 | C.氢氧化钠溶液 | D.硫酸铜溶液 |
B
A错,常温下,铁与浓硫酸发生钝化阻止反应的进一步进行。
B可以,铁与稀硫酸反应放出氢气。
C错,铁与氢氧化钠不发生反应。
D错,铁与硫酸铜发生置换,生成铜,不放出气体。
B可以,铁与稀硫酸反应放出氢气。
C错,铁与氢氧化钠不发生反应。
D错,铁与硫酸铜发生置换,生成铜,不放出气体。

练习册系列答案
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
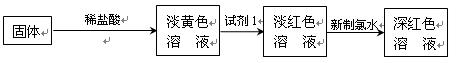
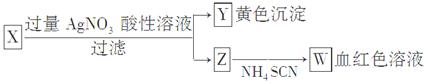
 的转化,A中Fe2+做 剂,B中Fe3+做 剂。
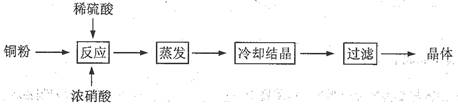
的转化,A中Fe2+做 剂,B中Fe3+做 剂。 中加入过量稀硝酸,得到0.448 L(标准状况下)一种无色气体.写出反应的离子方程式: ,待测溶液中c(Cu2+)= mol/L.
中加入过量稀硝酸,得到0.448 L(标准状况下)一种无色气体.写出反应的离子方程式: ,待测溶液中c(Cu2+)= mol/L.