题目内容
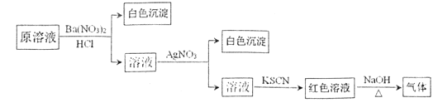
【题目】J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素。
![]()
(1)M的离子结构示意图为_____;元素T在周期表中位于第_____族。
(2)J和氢组成的化合物分子有6个原子,其结构简式为______。
(3)M和T形成的化合物在潮湿的空气中冒白色烟雾,反应的化学方程式为_____。
(4)L的最简单气态氢化物甲的水溶液显碱性。
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为______。
②一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是_______(选填序号)。
选项 | a | b | c | d |
x | 温度 | 温度 | 加入H2的物质的量 | 加入甲的物质的量 |
y | 甲的物质的量 | 平衡常数K | 甲的转化率 | 生成物物质的量总和 |
(5)由J、R形成的液态化合物JR2 0.2mol在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215kJ。 该反应的热化学方程式为________。
【答案】![]() ⅦA CH2=CH2 AlCl3+3H2O=Al(OH)3+3HCl↑ 2NH3·H2O+3H2O2=N2↑+8H2O或2NH3+3H2O2=N2↑+6H2O a和c CS2(l)+3O2(g)=CO2(g)+2SO2(g) △H=-1075kJ/mol
ⅦA CH2=CH2 AlCl3+3H2O=Al(OH)3+3HCl↑ 2NH3·H2O+3H2O2=N2↑+8H2O或2NH3+3H2O2=N2↑+6H2O a和c CS2(l)+3O2(g)=CO2(g)+2SO2(g) △H=-1075kJ/mol
【解析】
J元素最低负化合价的绝对值与其原子最外层电子数相等,则J为C元素;根据J、R在周期表中的相对位置可知R为S元素;则T为Cl元素;M是地壳中含量最多的金属元素,则M为Al元素;根据L的最简单气态氢化物甲的水溶液显碱性可L为N元素。
(1)M为Al,其离子结构示意图为![]() ;元素T为Cl,最外层有7个电子,在周期表中位于第ⅦA族。
;元素T为Cl,最外层有7个电子,在周期表中位于第ⅦA族。
(2)J为C,和氢组成的化合物分子有6个原子,则为乙烯,其结构简式为CH2=CH2。
(3)M和T形成的化合物AlCl3在潮湿的空气中冒白色烟雾,即AlCl3和空气在的水蒸气反应生成白色固体Al(OH)3,同时生成HCl,反应的化学方程式为AlCl3+3H2O=Al(OH)3+3HCl↑。
(4)①在微电子工业中,甲的水溶液即氨水可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,氨水中的-3价氮被H2O2氧化为N2,其化学方程式为2NH3·H2O+3H2O2=N2↑+8H2O或2NH3+3H2O2=N2↑+6H2O。
②一定条件下,氨在固定体积的密闭容器中发生分解反应2NH3(g)![]() N2(g)+3H2(g)(△H>0)达平衡后,a.升高温度,平衡正向移动,氨的物质的量减小,正确;b.升高温度,平衡正向移动,平衡常数增大,错误;c.增加氢气的物质的量,平衡逆向移动,氨的转化率降低,正确;d.再加入氨,平衡正向移动,生成更多的生成物,错误;故选ac;
N2(g)+3H2(g)(△H>0)达平衡后,a.升高温度,平衡正向移动,氨的物质的量减小,正确;b.升高温度,平衡正向移动,平衡常数增大,错误;c.增加氢气的物质的量,平衡逆向移动,氨的转化率降低,正确;d.再加入氨,平衡正向移动,生成更多的生成物,错误;故选ac;
(5)由J、R形成的液态化合物CS2 0.2mol在O2中完全燃烧,生成两种气态氧化物,即CO2和SO2,298K时放出热量215kJ,则1mol CS2在氧气在完全燃烧,放出的热量为215kJ ×5=1075kJ的热量,故该反应的热化学方程式为CS2(l)+3O2(g)=CO2(g)+2SO2(g) △H=-1075kJ/mol。